Министерство образования и науки Украины
Реферат на тему: «Методы определения белков. Кислотный метод измерения жирности продуктов.»
СОДЕРЖАНИЕ:
1.
Белки, их аминокислотный состав, продукты протеолиза………………………………………………………….…3
2.
Определение белковой фракции пищи………………………………………………………...…………4
2.1.1.
Цветные реакции……………………………………………………………….....….….....4
2.1.2.
Реакции осаждения……………………………………………………...……..…...6
2.2.
Количественное определение белка……………………………………………………………..……………......6
2.3.
Ускоренный метод определения белков в готовых блюдах и рационах……………………………………………………………………….…9
3.
Кислотный метод измерения жирности продуктов………………… 9
4.
Список литературы……………………………………………………11
1. БЕЛКИ, ИХ АМИНОКИСЛОТНЫЙ СОСТАВ, ПРОДУКТЫ ПРОТЕОЛИЗА
Белки представляют главнейшую составную часть пищи человека, и потому количественное определение белковой фракции пищи и изучение ее аминокислотного состава дает важный материал для суждения о питательной ценности пищевых продуктов и пищу в целом.
Белки в то же время, как наименее устойчивое пищевое вещество, легко подвергаются распаду в результате воздействия бактериальных ферментов (реже ферментов самой пищи-аутолиз), что ведет к порче продуктов.
Белки сначала распадаются на протеазы, пептоны, пептиды, которые, не накапливаясь, распадаются на аминокислоты. В дальнейшем происходит расщепление аминокислот ,которое может идти различными путями: декарбоксилированием, дезаминированием, обоими этими путями совместно в результате образуются азотистые основания(аммиак, амины) жирные кислоты, свободные углеводороды и пр. Конечными продуктами распада и превращения белков являются сероводород, аммиак, меркаптаны, фенол, индол, скатол и др.
Необходимо, однако, указать, что по отдельным химическим показателям нельзя судить о порче белковых продуктов питания. Так, накопление аминокислот не дает еще представления о порче, например, мяса. То же можно сказать о положительных качественных реакциях на аммиак и сероводород, которые обнаруживаются иногда и в совершенно свежем мясе. Методы, основанные на качественном обнаружении типичных продуктов гниения белка – индола, скатола, фенола, меркаптанов, не имеют практического значения, так как эти продукты обнаруживаются лишь тогда, когда развитие гнилостного распада не вызывает уже сомнения по одним органолептическим показателям.
Вот несмотря на большую давность вопроса о способах обнаружения порчи белковых продуктов питания, особенно на ранних стадиях протеолиза, этот вопрос не нашел еще своего разрешения, и в литературе появляются все новые и новые предложения по этому поводу.
Нет сомнения в том, что только в комплексах методов, слагающихся из органолептических, химических и микробиологических исследований, нужно искать разрешение вопроса.
2. ОПРЕДЕЛЕНИЕ БЕЛКОВОЙ ФРАКЦИИ ПИЩИ
2.1. Качественные реакции на белок
Для качественного обнаружения белка предложено много реакций( цветный и осадочные ).
2.1.1. Цветные реакции
Б и у р е т о в а я р е а к ц и я.К раствору белка добавляют равный объем 10% раствора едкого натра и затем по каплям 0,1% раствор сернокислой меди. Жидкость приобретает фиолетовое окрашивание, переходящее в красное, если, наряду с белками , имеются альбумозы и пептоны. Реакция обусловлена наличием в белковой молекуле группировок
—CO—NH, т.е. пептидных связей. Продукты гидролиза белка ( аминокислоты и амиды) после достаточного разбавления этого эффекта не дают эффекта и потому биуретовой реакцией можно пользоваться для установления конца гидролиза белка.
Появление сине-фиолетового окрашивания при описанной реакции обусловлено образованием Сu—Na – комплексной соли биурета.
Следует избегать прибавления избытка медного купароса, так как голубая получающегося гидрата окиси меди может маскировать реакцию.
Кроме белков, биуретовую реакцию дают: биурет (NH2—СО—HN—СО—NH2),
оксамид (H2N—СО—СО—NH2), глицинамид (H2N—СH2—СО—NH2),малонамид
(H2N—СО—СH2—СО—NH2), а также следующие аминокислоты а достаточно концентрированных растворах: гистидин, серин и треонин. Таким образом, биуретовая реакция не является строго специфичной для полипептидных цепей.
Присутствие в исследуемом растворе MgSO4 и (NH4) 2SO4 препятствует биуретовой реакции. При налички аммонийных солей следует употреблять большой избыток едкой щелочи.
Н и н г и д р и н о в а я р е а к ц и я.К 3мл нейтрального водного раствора белка добавляют 1 мл свежеприготовленного 0,1% раствора нингидрина(трикетогидринденгидрата);
Смесь нагревают до кипения и через минуту охлаждают. Появляется синее окрашивание. Объясняется это ем, что нингидрин дает окрашивание(обычно синее) с любой α- аминокислотой, а так как любой белок содержит α-аминокислоты, то нингидриновая реакция получается со всеми без исключения белками. Химизм реакции можно представить в следующем виде:
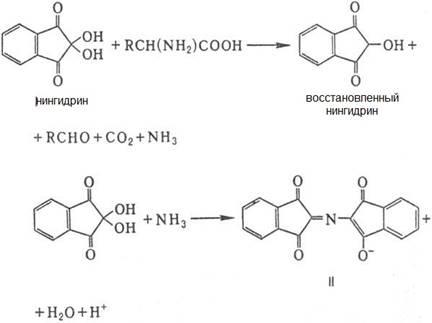
Восстановленный нингидрин с аммиаком и второй молекулой нингидрина образует окрашенный в синий цвет продукт конденсации.
Нужно иметь в виду, что аммонийные соли и β-аланин также дают положительную нингидриновую реакцию. Добавление аскорбиновой кислоты повышает чувствительность реакции.
К с а н т о п р о т е и н о в а я р е а к ц и я.К раствору белка приливают концентрированной азотной кислоты(уд. вес. 1,4); при этом белок выпадает в осадок. При нагревании осадок частью растворяется и жидкость окрашивается в желтый цвет. При этом происходит образование нитросоединений циклических аминокислот: тирозина и триптофана, которые содержатся в подавляющем большинстве белков.
Если полученный желтый раствор охладить, а затем осторожно добавить немного раствора едкой щелочи или аммиака, то появляется красновато-оранжевое окрашивание, обусловленное образованием солей нитроновых кислот.
Р е а к ц и я А д а м к е в и ч а. Аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
К одной капле белка прибавляют 10 капель уксусной кислоты. Наклонив пробирку, осторожно по стенке добавляют по каплям 0,5 мл серной кислоты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Р е а к ц и я Ф о л я. Аминокислоты, содержащие сульфгидрильные группы - SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и NaOH), образует осадок сульфида свинца PbS черного или бурого цвета.
К 5 каплям раствора белка прибавляют 5 капель реактива Фоля и кипятят 2-3 мин. После отстаивания 1-2 мин. появляется черный или бурый осадок.
2.1.2. Реакции осаждения
Для белков характерны реакции осаждения солями и гидратами окисей тяжелых металлов и некоторыми кислотами. Приведем важнейшие из этих реакций.
Осаждение белков тяжелыми металлами
Осаждение белков солями тяжелых металлов производится обычно в нейтральном млм слабокислом растворе. Полноте осаждения часто способствует присутствие солей щелочных металлов—К SO4, MgSO4 и др.
Следует иметь ввиду, что во многих случаях образующиеся осадки могут растворяться в избытке реактива.
Х л о р н о е ж е л е з о и у к с у с н о е ж е л е з о осаждают белки из их растворов; осадок легко растворяется в избытке хлорного железа.
Х л о р н а я р т у т ь (сулема) осаждает белки и продукты частичного гидролиза их- пептоны.
У к с у с н р к и с л ы й с в и н е ц - нейтральный и основной (свинцовый уксус) является хорошим осадителем белков.
Г и д р а т о к и с и м е д и и г и д р а т о к и с и ц и н к а осаждают белки.
Гидрат окиси цинка, кроме белков, осаждает еще глутатион, мочевую кислоту и креатинин.
Осаждение белков кислотами
При осаждении белков кислотами происходит образование солей, устойчивых в кислой среде. В избытке реактива осадки могут раствориться.
Т р и х л о р у к с у с н а я и м е т а ф о с ф о р н а я к и с л о т ы осаждают только белки.
Сульфосалициловая кислота в форме кислого суфосалициловокислого натра и
В о л ь ф р а м о в а я к и с л о т а являются также осадителями белков.
2.2. Количественное определение белка
Среди азотистых веществ, входящих в состав пищевых продуктов, растительного и животного происхождения главное место принадлежит белкам. В связи с этим содержание белков в пищевых продуктах часто определяют на основании найденного в продукте количества общего азота; при этом при пересчете азота на белок исследуемого продукта учитывают процентное содержание азота в белке данного продукта; так, например, если азот составляет 16% белка продукта, то, очевидно, для пересчета найденного количества азота на белок нужно весовое количество азота умножить на 6,25. Таким образом, для данного случая пересчетным коэффициентом является число 6,25.
Этот способ расчета белка дает представление о содержании в продуктах не чистого белка, а так называемого «сырого протеина», так как вместе с азотом белка по обычно применяемому методу Кьельдаля определения азота, а пищевых продуктах одновременно определяется азот и других соединений, могущих присутствовать в пищевых продуктах; сюда относятся альбумозы и пептоны, аминокислоты, нуклеиновые кислоты, амиды, азотосодержащие экстрактивные вещества (креатин, мочевина, мочевая
кислота), алкалоиды(кофеин, теин, теобромин), некоторые глюкозиды( соланин, вицин, синигрин), некоторые азотосодержащие неорганические соединения( аммонийные и азотнокислые соли, свободный аммиак) и др. В отдельных случаях содержание некоторых из перечисленных веществ может достигать заметных размеров: так, содержание в мясе азотосодержащих экстрактивных веществ доходит до 10%.
М е т о д К ь е л ь д а л я состоит в том, что органические азотосодержащие вещества подвергаются разрушению с помощью крепкой серной кислоты с применением катализатора и при нагревании. При этом углерод и водород органических соединений полностью окисляются до СО2 и Н2О за счет кислорода, освобождающегося при восстановлении серной кислоты. Азот органических веществ отщепляется в виде аммиака, который с серной кислотой образует сульфат аммония.
При помощи крепкой щелочи разлагают затем сульфат аммония и освободившийся при этом аммиак отгоняют и улавливают в титрованный раствор серной кислоты, который берется с избытком. Обратным титрованием определяют этот избыток, а отсюда делают вывод о количестве кислоты, связавшейся с аммиаком и о количестве азота сожженного вещества.
Д л я о п р е д е л е н и я к о л и ч е с т в а б е л к а в о б р а з ц е и с п о л ь з у е т с я р я д м е т о д и к :
1.Биуретовый метод
2.Микробиуретовый метод
3.Метод Бредфорда
4.Метод Лоури
5.Спектрофотометрический метод
Б и у р е т о в ы й м е т о д.Основан на образовании биуретового комплекса (имеет фиолетовый цвет) пептидных связей белков с двухвалентными ионами меди. В методе используют т. н. биуретовый реактив, состоящий из KOH, CuSO4 и цитрата натрия (или тартрата натрия). В образовавшемся комплексе медь связана с 4 азотами координационными связями, а с 2 кислородами — электростатическими. Полноценный комплекс образуется лишь с пептидами, состоящими более чем из 4 остатков.
Интенсивность окраски раствора прямо пропорциональна концентрации белка в сыворотке и определяется фотометрически.
К достоинствам метода стоит отнести его низкую чувствительность к посторонним веществам, невысокую погрешность.
М и к р о б и у р е т о в ы й м е т о д основан на образовании окрашенного в фиолетовый цвет комплекса, образующегося в результате взаимодействия пептидных связей с Cu2+ в щелочной среде. К 0,2 мл ПМ лимфоцитов, сыворотки или плазмы добавляли 3,5 мл раствора NаОН и 0,2 мл реактива Бенедикта. Выдерживали 15 мин при комнатной температуре и спектрофотометрировали на СФ — 46 при 330 нм. Построение калибровочного графика проводили по стандартному раствору белка.
М е т о д Б р э д ф о р д а один из наиболее популярных методов, используемый для определения концентрации белка в растворе. Метод определения концентрации белка по Брэдфорд успешно используется в случае измерения растворов с низкой концентрацией белка и растворов, содержащих компоненты, также обладающие значительным поглощением при 280 нм. Метод определения концентрации белка по Брэдфорд, так же, как и метод Лоури и BSA, требует построения стандартной калибровочной кривой перед измерением концентрации неизвестного белка.
Универсальность метода и его гибкость позволяют создавать модификации процедуры измерений для различных целей и типов измерений.
Метод Брэдфорд основан на сдвиге спектра поглощения кумасси (Coomassie Blue) в сторону значений 595 нм прямо пропорционально концентрации содержащегося в растворе белка. Кумасси образует комплекс с белком; этот комплекс измеряют при длине волны 595 нм. абсорбционная фотометрия комплекса кумасси / белок имеет очень высокую чувствительность и эффективна даже в случае следовых концентраций белков.
М е т о д Л о у р и. Метод количественного определения белка, основанный на измерении концентрации окрашенных продуктов, образующихся в результате сочетания двух химических реакций: биуретовой реакции на пептидную связь и взаимодействия реактива Фолина-Чокалтеу с ароматическими аминокислотами.
С п е к т р о ф о т о м е т р и ч е с к и й м е т о д. Спектрофотометрия (абсорбционная) — физико-химический метод исследования растворов и твёрдых веществ, основанный на изучении спектров поглощения в ультрафиолетовой (200—400 нм), видимой (400—760 нм) и инфракрасной (>760 нм) областях спектра. Основная зависимость, изучаемая в спектрофотометрии зависимость интенсивности поглощения падающего света от длины волны. Спектрофотометрия широко применяется при изучении строения и состава различных соединений (комплексов, красителей, аналитических реагентов и др.), для качественного и количественного определения веществ (определения следов элементов в металлах, сплавах, технических объектах).
2.3. Ускоренный метод определения белков в готовых блюдах и рационах
Для ускоренного определения белков в готовых блюдах и рационах В. А. Бабин и Н.Н. Мусерский разработали метод, представляющий модификацию метода, предложенного Джеремилло.
Сущность метода сводится к тому, что вещество, содержащее белки, минерализуется в металлической гильзе (медь, нержавеющая сталь, никель), которая герметически закрывается ввинчивающейся металлической пробкой с газоотводной трубкой, через которую газообразный аммиак и другие газы, образующиеся при минерализации, поступают в приемную колбу с серной кислотой.
Минерализация белков производится едким натром, растворенным в расплавленном уксусном натре при нагревании гильзы. Процесс минерализации белка происходит быстро ( в течении 2-3 минут) при температуре нагрева не выше 325ºС, что является преимуществом данного метода перед другими методами количественного определения белка.
3. КИСЛОТНЫЙ МЕТОД ИЗМЕРЕНИЯ ЖИРНОСТИ ПРОДУКТОВ
Рассмотрим данный метод на примере измерения жирности молока и молочных продуктов.
Метод основан на выделении жира из молока и молочных продуктов под действием концентрированной серной кислоты и изоамилового спирта с последующим центрифугированием и измерении объема выделившегося жира в градуированной части жиромера.
Чтобы определить содержание жира в молоке, освобождают жировые шарики от белковых оболочек. В качестве растворителя применяют концентрированную серную кислоту. Для более полного выделения освободившегося от оболочек жира употребляют изоамиловый спирт. При последующем центрифугировании смеси жир, как наиболее легкая составная часть, концентрируется в градуированной шкале стеклянного прибора — жиромера.
Если молоко исследуется вскоре после отбора, то его хорошо перемешивают, переворачивая до 6 раз закрытые бутылочки с пробами. При этом не допускают образования пены, которая приводит к неправильному отмериванию. Особенно тщательно подливают пробы долго стоявшего молока. Иногда их прогревают в воде, чтобы смыть жировой слой, приставший к стенкам бутылочки, а затем перемешивают.
В штатив устанавливают нужное количество пронумерованных жиромеров. Нумеруют жиромеры путем загибания вокруг шкалы жестяных пластинок с высеченными номерами.
В каждый жиромер отмеривают дозатором 10 мл серной кислоты. Потом отбирают пипеткой 10,78 мл (11 г) хорошо перемешанного молока. Осторожно, по стенке вливают молоко в жиромер. Во избежание преждевременного разогревания слой молока должен расположиться над слоем кислоты. При этом конец пипетки не должен касаться серной кислоты.
Отмеривают дозатором 1 мл изоамилового спирта, стараясь не смочить горлышко жиромера, что в последующем может привести к выскакиванию пробки.
Заполненные жиромеры закрывают резиновыми пробками и вставляют в центрифугу, привинчивают крышку центрифуги и центрифугируют 5 мин со скоростью около 1000 об/мин. По окончании центрифугирования жиромеры на 5 мин устанавливают пробками вниз в водяную баню при 65 °С.
4.СПИСОК ЛИТЕРАТУРЫ:
1. «Вопросы питания»,В. А. Бабин, Н.Н. Мусерский, 1958г;
2. «Методы исследований пищевых продуктов», А.И. Бурштейн,Киев 1963г;
3. «Мясная индустрия СССР», 1951г.
Интернет - источники:
1. http://dic.academic.ru;
2. http://ru.wikipedia.org/;
3. http://meddd.ru/;
4.http://tehstandart.com/;
5.http://pda./.
|