|
§8 Элементы
VI
А группы.
Кислород, сера, селен, теллур, полоний.
| Элементы
|
O
|
S
|
Se
|
Te
|
Po
|
| Содержание в земной коре мас,%
|
47,2
|
1
|
6∙10-5
|
1∙10-6
|
2∙10-6
|
| Валентная электронная конфигурация
|
2s2
2p 4
|
3s2
3p4
|
4s2
4p4
|
5s2
5p4
|
6s2
6p4
|
| Атомный радиус,нм
|
0,073
|
0,104
|
0,116
|
0,135
|
-
|
| Ионный радиус,нм
|
0,140
|
0,174
|
0,191
|
0,211
|
-
|
| Потенциал ионизации,еВ
|
13,61
|
10,36
|
9,75
|
9,01
|
8,43
|
| ОЭО
|
1,47
|
2,08
|
2,02
|
2,00
|
1,35
|
| Температура пл.0
С
|
-218,8
|
-112,8
|
220,5
|
450,0
|
250,0
|
| Температура кип.0
С
|
-183,0
|
44,6
|
657,0
|
990,0
|
-
|
| Плотность,г/м 3
|
1,13
|
2,07
|
4,82
|
6,25
|
9,50
|
Общие сведения элементов
VI А группы:
Элементы VI А группы (кроме полония) называются халькогенидами. На внешнем электронном уровня этих элементов находятся шесть валентных электронов (ns2
np 4
),поэтому они в нормальном состоянии проявляют валентность 2, а в возбужденном -4 или 6 (кроме кислорода). Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое, что обуславливает большие энергетические затраты на «распаривание» его электронов, некомпенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленными электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Электроотрицательность этих элементов постепенно уменьшается в порядке О-S-Se-Те-Ро. Cтепень окисления от -2,+2,+4,+6 . Увеличивается радиус атома, что ослабляет неметаллические свойства элементов.
Элементы этой подгруппы образуют с водородом соединения вида H2
R (H2
О,H2
S,H2
Se,H2
Те,H2
Ро).Эти соединения растворяясь в воде, образуют кислоты. Кислотные свойства увеличиваются в направлении H2
О→H2
S→H2
Se→H2
Те→H2
Ро. S,Se и Те образуют с кислородом соединения типа RO2
и RO3.
Из этих оксидов образуются кислоты типа H2
RO3
и H2
RO4.
С увеличением порядкового номера,силы кислот уменьшаются. Все они имеют окислительные свойства. Кислоты типа H2
RO3
проявляют и восстановительные свойства.
Кислород
Природные соединения и получения:
Кислород - самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе (21%); в связанном виде входит в состав воды (88,9%), минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Атмосферный воздух представляет собой смесь многих газов, основную часть которой составляют азот и кислород, и небольшое количество благородные газы, углекислый газ и водяные пары. Углекислый газ образуется в природе при горении дерева, угля и других видов топлива, дыхании животных, гниении. В некоторых местах земного шара CO 2
выделяется в воздух вследствие вулканической деятельности, а также из подземных источников.
Природный кислород состоит из трех стабильных изотопов: 8
16
О(99,75%),8
17
О(0,04), 8
18
О(0,20). Искусственным путем были также получены изотопы 8
14
О, 8
15
О, 8
19
О.
Кислород был получен впервые в чистом виде К.В.Шееле в 1772 г., а затем в 1774 г. Д.Ю.Пристли, который выделил его из HgO. Однако Пристли не знал, что полученный им газ входит в состав воздуха. Только спустя несколько лет Лавуазье,подробно изучивший свойства этого газа , установил, что он является основной частью воздуха.
В лаборатории кислород получается следующими методами:
Э
лектролизом воды.
Чтобы увеличить электропроводность воды в нее добавляют раствор щелочи (обычно 30%-ый KOH) или сульфаты щелочных металлов:
В общем виде: 2H2
О →2H2
+О2
На катоде: 4H2
О+4e¯→ 2H2
+4OH¯
На аноде: 4OH−4е→2H2
О+О2
- Разложением кислородосодержащих соединений:
Термическое разложение Бертолетовой соли под действием катализатора MnO2.
KClO3
→2KCl+3О2
Термическое разложение перманганата калия
KMnO4
→K2
MnO4
+MnO2
+О2.
Термическое разложение нитратов щелочных металлов:
2KNO3
→2KNO2
+О2.
Разложением пероксидов:
2H2
О 2
→2H2
О+О2.
2ВаО2
→2ВаО+О2.
Термическим разложением оксида ртути (II):
2HgO→2HgO+О2.
- Взаимодействием пероксидов щелочных металлов с оксидом углерода (IV):
2Na2
О2
+2CO2
→2Na2
CO 3
+О2.
Термическим разложением хлорной извести в присутствии катализатора - солей кобальта:
2Ca(OCl)Cl →2CaCl 2
+О2.
-Окислением пероксида водорода перманганатом калия в кислой среде:
2KMnO4
+H2
SO4
+5H2
О 2
→K2
SO4
+2Mn SO4
+8H2
О+5О2.
В промышленности:
В настоящее время в промышленности кислород получают фракционной перегонкой жидкого воздуха . При слабом нагревании жидкого воздуха из него сначала отделяется азот (tкип
(N2
)=-196ºC), затем выделяется кислород (tкип
(О2
)=-183ºС).
Кислород полученный этим способом содержит примеси азота. Поэтому для получения чистого кислорода полученную смесь заново дистиллируют и в конечном итоге получается 99,5% кислород. Кроме того некоторое количество кислорода получают электролизом воды. Электролитом служит 30% раствор KOH.
Кислород обычно хранят в баллонах синего цвета под давлением 15МПа.
Физико-химические свойства:
Кислород - газ без цвета , запаха , вкуса , немного тяжелее воздуха, слабо растворяется в воде. Кислород при давлении 0,1 МПа и температуре -183ºС переходит в жидкое состояние, при -219ºС замерзает. В жидком и твердом состоянии притягивается магнитом.
Согласно методу валентных связей строение молекулы кислорода, представленное схемой -:Ö::Ö:,
не объясняет большую прочность молекулы, имеющей паромагнитные свойства, то есть неспаренные электроны в нормальном состоянии.
В результате связи электронов двух атомов образуется одна общая электронная пара, после этого неспаренный электрон в каждом атоме образует взаимную связь с неразделенной парой другого атома и между ними образуется трех электронная связь. В возбужденном состоянии молекула кислорода проявляет диамагнитные свойства, которым соответствует строение по схеме :Ö=Ö:,
Для заполнения электронного уровня в атоме кислорода не хватает двух электронов. Поэтому кислород в химических реакциях может легко присоединять два электрона и проявлять степень окисления -2. Кислород только в соединениях с более электроотрицательным элементом фтором проявляет степень окисления +1 и +2: О2
F 2
,ОF 2.
Кислород - сильный окислитель. Он не взаимодействует только с тяжелыми инертными газами (Kr,Xe,He,Rn), с золотом и платиной. Оксиды этих элементов образуются другими путями. Кислород входит в реакции горения, окисления как с простыми веществами так и со сложными. При взаимодействии неметаллов с кислородом образуются кислотные или соленеобразующие оксиды, а при взаимодействии металлов образуются амфотерные или смешанные оксиды Так, с фосфором кислород реагирует при температуре ~ 60 °С,
4P+5О2
→ 2Р2
О5
С металлами- оксиды соответствующих металлов
4Al + 3O2
→ 2Al2
O3
3Fe + 2O2
→ Fe3
O4
при нагревании щелочных металлов в сухом воздухе только литии образует оксид Li2
O, а остальные-пероксиды и супероксиды:
2Na+O2
→Na2
O2
K+O2
→KO2
С водородом кислород взаимодействует при 300 °С:
2Н2
+ О2
= 2Н2
О.
При взаимодействии с фтором он проявляет восстановительные свойства:
O2
+ F2
= F2
O2
(в электрическом разряде),
с серой - при температуре около 250 °С:
S + О2
= SO2
.
С графитом кислород реагирует при 700 °С
С + О2
= СО2
.
Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде:
N2
+ О2
 2NО - Q. 2NО - Q.
Кислород реагирует и со многими сложными соединениями, например, с оксидом азота (II) он реагирует уже при комнатной температуре:
2NО + О2
= 2NО2
.
При окислении сероводорода, при нагревании, образуется сера, или оксид серы (IV) в зависимости от соотношения между кислорода и сероводорода :
2Н2
S + О2
= 2S + 2Н2
О
2Н2
S + ЗО2
= 2SО2
+ 2Н2
О
В большинстве реакций окисления с участием кислорода выделяется тепло и свет - такие процессы называются горением.
Озон
Озон-O3
-вторая аллотропная модификация элемента кислорода. Молекула O3
имеет угловое строение (угол между связями 116º, длинна связи О=О, l=0,1278нм) При н.у. это газ синего цвета. Жидкий озон- темно-синего цвета. Он ядовит и взрывчат особенно в жидком и твердом состоянии). Озон образуется в атмосфере при грозовых разрядах, и имеет специфический запах свежести.
Обычно озон получают в озонаторах пропусканием тихого электрического разряда через кислород (реакция эндотермическая и сильно обратима; выход озона составляет 5%):
3О2
 2О3
ΔН=-285 кДж. В лабораторных условиях озон получают при подкислении азотной кислотой персульфата 2О3
ΔН=-285 кДж. В лабораторных условиях озон получают при подкислении азотной кислотой персульфата
аммония:
(NH4
)2
S2
O8
→H2
S2
O8
+2NH4
+
H2
S2
O8
→2SO2
+O3
+H2
O
O3
образуется с небольшим выходом в результате реакции:
3F2
+H2
O(г)→6HF+O3
O3
-сильнейший окислитель, окисляет все металлы ,( кроме золота и платиновых металлов) и большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов- в их сульфаты. В реакциях с участием О3
обычно образуется О2
, например:
2Ag+O3
→Ag2
O+O2
PbS+4O3
→PbSO4
+4O2
NH2
+3O3
→HNO2
+H2
O
Pb(OH)2
+O3
→PbO2
+H2
O+O2
При воздействии O3
на щелочные металлы можно получить озониды- неустойчивые соединения, которые разлагаются:
2KO3
→2KO2
+O2
Как сильный окислитель ,озон убивает бактерии и потому применяется для дезинфекции воздуха. Устойчивый слой озона находится в атмосфере на высоте~22км. Этот озоновый слой защищает Землю от губительного для жизни чистого ультрафиолетового излучения.
При взаимодействии озона с раствором иодида калия выделяется йод, тогда как с кислородом эта реакция не идет:
2КI + О3
+ Н2
О = I2
+ 2КОН + О2
.
Реакция часто используется как качественная для обнаружения ионов I-
или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся йодом, причем качественная еще и потому, что озон не окисляет ионы Сl-
и Br-
.
Вода
Физические и химические свойства воды:
Чистая вода представляет собой б
есцветную, без вкуса, запаха, прозрачную жидкость. Плотность воды при переходе ее
из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает.
Вода-вещество привычное и необычное. Нет на земле вещества, более важного для нас, чем обыкновенная вода, и в то же время не существует другого вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в ее свойствах.
Почти ¾ поверхности нашей планеты занято океанами и морями. Твердой водой- снегом и льдом- покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У нее очень большая теплоемкость. Нагреваясь, она поглощает тепло, остывая, отдает его. Земная вода и поглощает и возвращает очень много тепла, тем самым выравнивает климат. От космического холода предохраняют Землю те молекулы, которые рассеяны в атмосфере- в облаках и в виде паров.
Вода по физическим свойствам существенно отличается от других растворителей: При 4ºС вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается. Если бы при понижении температуры и при переходе из жидкого состояния в твердое вода изменялась аналогично другим веществам, то при приближении зимы поверхностные слои природных вод охладилась бы до 0ºС и опускались на дно до тех пор, пока вся масса водоема не приобрела бы температуру 0ºС. Вода замерзала бы, льдины погружались на дно, и водоем промерзал бы на всю глубину. Многие формы жизни в воде были бы невозможны. В действительности охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от охлаждения.
Вода обладает аномально высокой теплоемкости (4,18 Дж/г∙К), поэтому в ночное время, а также при переходе от лета к зиме, вода остывает медленно. А днем, или при переходе от зимы к лету , так же медленно нагревается , являясь, таким образом регулятором температуры на земном шаре.
Вода при обычном состоянии является жидкостью, в то время как H2
S,H2
Se,H2
Te- газы. Температуры кристаллизации и испарения воды значительно выше соответствующих температур указанных соединений.
Вода обладает очень высокой диэлектрической проницаемостью (78.5 при 298К).
Вода- хороший растворитель полярных жидкостей и соединений с ионными связями, образует кристаллогидраты со многими химическими соединениями.
Долгое время необычные свойства воды были загадкой для ученых. Они в основном обусловлены следующими причинами:
- полярный характер молекул;
- наличие не поделенных электронных пар у атома кислорода;
- водородные связи.
Связь между атомами водорода и кислорода полярная, что приводит к асимметрии в распределении электронных зарядов и, следовательно, к полярности молекулы. Длина связи составляет 96 нм, а угол между связями ~ 105º.
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к кислороду обуславливают образование водородных связей. Энергия связи равна 25 кДж/моль. Атом кислорода в молекуле воды находится в состоянии sp3
-гибридизации. Поэтому валентный угол НОН близок к тетраэдическому углу (109,5º).
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкости оказывается более высокой. Это свидетельствует о том, что в жидкой фазе происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты, вследствие образования между молекулами водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды.
Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы воды. При плавлении льда его структура разрушается, но и в жидкой фазе сохраняются водородные связи, образуются ассоциаты , однако они существуют короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды, при этом упаковка молекул воды становится плотной. Именно поэтому при плавлении льда объем , занимаемый водой, уменьшается, а ее плотность возрастает . При нагревании воды часть теплоты затрачивается на разрыв водородных связей. Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
На Земле на 6800 атомов протия приходится один атом дейтерия, а в межзвездочном пространстве один атом дейтерия приходится уже на 200 атомов протия.
Вода- весьма реакционноспособное вещество.
Вода реагирует со многими металлами
с выделением водорода:
2Na + 2H2
O = H2
+ 2NaOH (бурно)
2K + 2H2
O = H2
+ 2KOH (бурно)
3Fe + 4H2
O = 4H2
+ Fe3
O4
(только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы .
Из неметаллов
с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2
O ® H2
+ CO
CH4
+ 2H2
O ® 4H2
+ CO2
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
2H2
O  2H2
+ O2 2H2
+ O2
Вода реагирует со многими оксидами
неметаллов
. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
P2
O5
+3H2
O→2H3
PO4
; N2
O5
+H2
O→2HNO3
Оксиды щелочных и щелоочно-земельных металлов вступают в реакции соединения с водой с образованием соответствующих щелочей:
CaO+H2
O→Ca(OH)2
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2
, Cr2
O3
, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней. Многие соединения металлов с неметаллами легко взаимодействуют с водой с образованием соответствующих гидроксидов металлов и водородных соединений неметаллов:
PCl3
+3H2
O → H3
PO3
+ 3HCl
Al2
S3
+6H2
O→2Al(OH)3
+3H2
S
Ca3
P2+6H2
O→3Ca(OH)2
+2PH3
Na3
N+3H2
O→3NaOH+NH3
KH+H2
O→KOH+H2
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты
. Если гидрат кристаллический, то он называется кристаллогидратом
, например:
CuSO4
+5 H2
O→CuSO4
.
5H2
O
H2
SO4
+ H2
O = H2
SO4
.
H2
O (гидрат серной кислоты)
NaOH + H2
O = NaOH.
H2
O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
Особая реакция воды- фотосинтез – синтез растениями крахмала (C6
H10
O5
)n
и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2
+ 5n H2
O = (C6
H10
O5
)n
+ 6n O2
(при действии света)
Вода обладает каталитической активностью. В отсутствии следов влаги практически не протекают обычные реакции, например, не окисляется натрий, белый фосфор, хлор не взаимодействует с металлами, фторводород не разрезает стекло.
Пероксид водорода
Пероксид водорода H2
O2
- соединение водорода c кислородом, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2
О2
содержатся пероксидные группы –О–О–которые во многом определяют свойства этого соединения.
Из-за несимметричного распределения связей Н-О молекула Н2
О2
сильно полярна. Между молекулами Н2
О2
возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода- сиропообразная жидкость бледно-голубого цвета (плотность 1,44) с довольно высокой температурой кипения (150ºС). При хранении Н2
О2
разлагается.
2H2
O2
® 2H2
O + O2
.
Получение Н2
О2
.
Молекулы Н2
О2
всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2
О2
образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например:
HO2
.
+ CH4
® H2
O2
+ CH3
либо в результате рекомбинации активных свободных радикалов:
2ОН.
® Н2
О2
,
Н.
+ НО2
.
® Н2
О2
.
Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2
О2
, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2
О2
немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2
О2
может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.
В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария:
BaO2
+2HCl®BaCl2
+H2
O2
,
а используют более современные методы. Один из них – электролиз растворов серной кислоты при высокой плотности тока, низкой температуре, на платиновом аноде. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO4
2–
– 2e ® S2
O8
2–
. Надсерная кислота затем гидролизуется:
H2
S2
O8
+ 2H2
O ® H2
O2
+ 2H2
SO4
.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением :
2H2
O ® H2
O2
+ H2
.
Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2
О2
и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида):
(СН3
)2
СНОН + О2
® (СН3
)2
С(ООН)ОН ® (СН3
)2
СО + Н2
О2
При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Физические и химические свойства.
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2
О2
, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3
). Замерзает Н2
О2
при температурой немного меньшей, чем температура замерзания воды – при минус 0,41°С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2
О2
замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30°С, а 60%-ный – при минус 53°С. Кипит Н2
О2
при температуре более высокой, чем обычная вода, – при 150,2ºС. Смачивает стекло хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2
О2
, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение:
Н2
О2
® Н2
О + 1/2 О2
с выделением 98 кДж на моль Н2
О2
(34г).Опасны и концентрированные водные растворы Н2
О2
, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.
Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2
О2
, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ),
Пероксид водорода – кислота, но очень слабая. Константа диссоциации H2
O2
 H+
+ HO2
–
при 25° С равна 2,4·10–12
, что на 5 порядков меньше, чем для H2
S. Средние соли Н2
О2
щелочных и щелочноземельных металлов обычно называют пероксидами. При растворении в воде они почти полностью гидролизуются: H+
+ HO2
–
при 25° С равна 2,4·10–12
, что на 5 порядков меньше, чем для H2
S. Средние соли Н2
О2
щелочных и щелочноземельных металлов обычно называют пероксидами. При растворении в воде они почти полностью гидролизуются:
Na2
O2
+ 2H2
O ® 2NaOH + H2
O2
.
Гидролизу способствует подкисление растворов. Как кислота Н2
О2
образует и кислые соли, например, Ва(НО2
)2
, NaHO2
и др. Кислые соли менее подвержены гидролизу, но легко разлагаются при нагревании с выделением кислорода:
2NaHO2
® 2NaOH + O2
.
Выделяющаяся щелочь, как и в случае Н2
О2
, способствует разложению.
Растворы Н2
О2
, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2
О2
на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2
О2
восстанавливается не до воды (как обычно), а до свободного водорода:. Окислительное действие разбавленных растворов Н2
О2
больше всего проявляется в кислой среде, например :
H2
O2
+ H2
C2
O4
® 2H2
O + 2CO2
,
но возможно окисление и в щелочной среде:
Na[Sn(OH)3
] + H2
O2
+ NaOH ® Na2
[Sn(OH)6
];
2K3
[Cr(OH)6
] + 3H2
O2
® 2K2
CrO4 + 2KOH + 8H2
O.
Окисление черного сульфида свинца до белого сульфата можно использовать для восстановления потемневших свинцовых белил на старых картинах:
PbS + 4H2
O2
® PbSO4
+ 4H2
O
Под действием света идет окисление и соляной кислоты:
H2
O2
+ 2HCl ® 2H2
O + Cl2
.
Добавление Н2
О2
к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2
O2
и разбавленной H2
SO4
растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3
, сернистый газ – до серной кислоты и т.д.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2
О2
может выступать как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н2
О2
), например:
2KMnO4
+ 5H2
O2
+ 3H2
SO4
® K2
SO4
+ 2MnSO4
+ 5O2
+ 8H2
O;
Ag2
O + H2
O2
® 2Ag + H2
O + O2
;
О3
+ Н2
О2
® H2
O + 2O2
;
NaOCl + H2
O2
® NaCl + H2
O + O2
.
Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию. Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н2
О2
позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
2K4
[Fe(CN)6
] + H2
O2
+ H2
SO4
® 2K3
[Fe(CN)6
] + K2
SO4
+ 2H2
O;
2K3
[Fe(CN)6
]+H2
O2
+2KOH®2K4
[Fe(CN)6
]+2H2
O+O2
.
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2
О2
применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2
О2
, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2
О2
на чистую воду и кислород.
8.2 Сера.
Нахождение в природе и получение:
Сера была известна людям со II века до нашей эры. Название элемента было взято со слова <<сира>> обозначающее светло-желтый. Сера распространена в природе как в виде соединений так и в свободном виде. В свободном виде сера встречается обычно в виде залежей. Такие рудники встречаются в северной части Украины, в Италии, в Америке, в Туркменистане. Кроме этого сера встречается в организмах животных и растений. В виде соединений сера распространена в виде сульфидов и сульфатов:
FeS2
-пирит или медный колчедан. H2
S-сероводород
ZnS- сфалерит или цинковая обманка Na2
SO4
∙10H2
O-сульфат натрия - глауберова
PbS- или свинцовый блеск. Соль
Cu2
S- или медный блеск (халькозин) CaSO4
∙2H2
O- гипс
CuFeS2
-медный колчедан или халькопирит. MgSO4
∙7H2
O- горькая соль
HgS- киноварь. BaSO4
- тяжелый шпат
В промышленности
серу получают путем выталкивания из рудников горячими струями пара. Чтобы получать серу этим способом в подземные трубы накачивают горячие струи пара и сжатый воздух. Под действием пара расплавившаяся сера поднимается по трубам с помощью горячих паров и воздушного давления , поднявшись превращается в кристаллы.
Чтобы отделить от примесей серу, полученную в свободном виде, плавят.
В промышленности чтобы получить серу из сульфида водорода H2
S окислением O2,
при 500°С участием катализатора ( активированного угля или Fe(OH)3
).
2H2
S+O2
→2H2
O+2S
SO2
+2C→S+2CO
SO2
+2H2
S→3S+2H2
O
В лаборатории
серу получают следующими способами:
-Термическим разложением пирита:
FeS2
→FeS +S
-Взаимодействием сульфида водорода с гологенами:
H2
S+Сl2
→2HCl+S H2
S+J2
→2HJ+S
H2
S+Br2
→2HBr+S
-Окислением сульфида водорода SO2
при высокой температуре:
2H2
S+SO2
→ 2H2
O+3S
-Восстановлением из сульфатов:
CaSO4
+4C→CaS+4CO
CaS+CO2
+H2
O→↓CaCO3
+H2
S
2H2
S +O2
→2S+2H2
O
Физические и химические свойства:
Сера имеет 4 стабильных изотопа: 33
S, 34
S, 35
S,36
S. Сера - кристаллическое вещество желтого цвета. Она не проводит тепла и электричества, не растворяется в воде, но растворяется в дисульфиде углерода ( CS 2
) , толуоле (C6
H5
-CH3
). Сера плавится при температуре 112,8 ºС,и кипит при температуре 444,6 ºС.
Сера имеет три аллотропных модификации: ромбическая, моноклинная, и пластическая. Первые 2 относятся к кристаллическим разновидностям, а третья – аморфная. Кристаллическая сера, состоящая из восьми атомов S8
при температуре > 160ºС распадается и переходит в различные виды пластической серы:
S8
450ºС
→ S6
650ºС
→ S4
900ºС
→S2
1500ºС
→S
Сера типичный неметалл. В химических реакциях сера проявляет себя как окислитель, так и восстановитель. Окислительные свойства серы выражены слабее чем у кислорода, поэтому в реакциях с элементами с большей электроотрицательностью (F, Cl, O, N) она проявляет себя как восстановитель, а с элементами с низшей электроотрицательностью чем у нее, она проявляет себя как окислитель. Сера вступает в реакции с металлами при нагревании, а с ртутью и щелочами взаимодействует при обычных условиях:
2Na+S→Na2
S 2Al+3S →Al2
S3
2Hg+S→HgS C+2S→CS2
Fe+S→FeS Si+S→SiS
Сера взаимодействует со всеми неметаллами кроме инертных газов и йода.
S+3F2
→SF6
Si+2S→SiS2
H2
+S→H2
S
2P+5S→P2
S5
S+O2
→SO2
2S+Cl2
→S2
Cl2
C+2S→CS2
Сера взаимодействует со сложными веществами:
Na2
S+S→Na2
S2
С горячими растворами концентрированной серной, с концентрированной и разбавленной азотной кислот:
2H2
SO4(
конц
)
+S→3SO2
+2H2
O
6HNO3(
конц
)
+S→2H2
SO4
+6NO2
+2H2
O
2HNO3(разб)
+S → H2
SO4
+2NO
При нагревании сера вступает в реакцию со щелочами и пероксидами:
Na2
O2
+2S→Na2
S+SO2
6KOH+3S→K2
SO3
+2K2
S+3H2
O
Сера используется в сельском хозяйстве как защита от насекомых, в производстве спичек, при получении серной кислоты, при вулканизации каучука, широко используется в производстве пороха.
Для приготовления черного пороха используется смесь из 75% KNO3
, 15% C и 10% S; при нагревании происходит реакция:
2KNO3
+ S + 3C → K2
S + 3CO2
+ N2
,
в результате которой происходят резкое увеличение объема смеси ( в 2000 раз) – взрыв.
Сероводород
Н2
S- бесцветный газ с резким запахом тухлых яиц; молекула Н2
S имеет угловую форму, длина связи S —H 0,1336 нм, угол HSH 92,06°.
При обычной температуре сероводород устойчив, в вакууме начинает диссоциировать выше 500 °С, при ~ 1690°С полностью разлагается. В воде Н2
S хорошо растворим ( 3 объема на 1 объем воды при 20°С. Водный раствор сероводорода-сероводородная кислота-слабая кислота (K
1
= 9,5·10-8
, K2
= 1·10-14
), образующая соли-сульфиды и гидросульфиды.
Известен клатрат Н2
S · 6Н2
О. Лучше, чем в воде,сероводород растворяется в органических растворителях; например, в одном объеме этанола растворяется 7,42 (20 °С) объемов H2
S. В промышленности сероводород получают как побочный продукт при очистке нефти, природных и промышленных газов. Основные методы очистки этих газов с получением сероводорода-моноэтаноламиновый, вакуум-карбонатный, содовый. Принципиальная схема выделения сероводорода из природных. и промышленных газов заключается в следующем: газ вводится в нижнюю часть абсорбера, который сверху орошается раствором абсорбента, затем насыщенный H2
S раствор поступает в отгонную колонну, где при нагревании горячим паром происходит десорбция сероводорода из раствора.
В лаборатории сероводород получают действием Н2
SO4
на FeS; а также из Н2
и паров S при 500-600 °С в присутствии катализатора (пемза); удобный метод получения H2
S-нагревание серы с парафином:
FeS+2HCl→FeCl2
+H2
S↑
Cероводород-сильный восстановитель:
KMnO4
+5H2
S+3H2
SO4
→2MnSO4
+5S+K2
SO4
+8H2
O
H2
S+4Br2
+4H2
O→H2
SO4
+8HBr
3FeCl3
+ H2
S → 2FeCl2
+ 2HCl + S
При нагревании на воздухе постепенно окисляется, при ~ 250 °С воспламеняется. Горит, при избытке О2
образует SO2
и воду, при недостатке-S и воду. Сероводород легко окисляется в водном растворе кислородом, галогенами. На восстановление I2
до HI в растворе основано определение H2
S методом иодометрии. Сильные окислители (HNO3
, Cl2
) окисляют сероводород до Н2
SO4
.
2H2
S + SO2
→ 2H2
O + 3S
3H2
S + 8HNO3
→ 3H2
SO4
+ 8NO + 4H2
O
Сероводород взаимодействует с большинством металлов и их оксидами при нагревании в присутствии влаги и воздуха с образованием сульфидов металлов.
Ca + H2
S → CaS + H2
CuO + H2
S → CuS↓ + H2
O
2NaOH + H2
S → Na2
S + 2H2
O
CuCl + H2
S → CuS↓ + 2HCl
С олефинами и гидроксидами, солями, спиртами, хлорароматическими соединениями, эпоксидами дает тиолы, с нитрилами –тиоамиды и другими соединениями S с водородом - сульфоны
H2
Sx
.
На реакции H2
S с солями тяжёлых металлов с образованием осадков основано определение сульфид-иона в растворе и атмосфере :
Pb(NO)3
+ H2
S → PbS↓(
черный
)
+ 2HNO3
В природе H2
S встречается главным образом в месторождениях нефти и природного газа, а также в вулканических газах и водах минеральных источников; он растворен в глубоких (ниже 150-200 м) слоях воды Черного моря (концентрация сероводород у дна достигает 11-14 мл/л). сероводород постоянно образуется в природе при разложении белковых веществ.
Сероводород применяют в основном для производства S и H2
SO4
. Его используют также для получения различных сульфидов (в частности, сульфидов и гидросульфидов Na, NH4
), сераорганических соединений (тиофены, тиолы и т. п.), тяжелой воды, для приготовления лечебных сероводородных ванн, в аналитической химии для осаждения сульфидов металлов. Взрывоопасен, ПДК (предельно допустимая концентрация) в воздухе 4,5-45,5% по объему.
Оксиды серы
Оксид серы
(IV) SО2
- сернистый ангидрид ,бесцветный газ с резким запахом, угнетающе действующий на растения. Молекула SО2
изоэлектронна молекуле озона, имеет угловую форму: валентный угол O- S- O равен 119о
. Кратность связи S- O составляет 1.5 .
Диоксид серы получают непосредственным сжиганием серы на воздухе или длительным отжигом сульфидов:
4FeS2
+ 11O2
→2Fe2
O3
+ 8SО2
SО2
хорошо растворяется в воде (39.3 объема в 1 объеме Н2
О при 20о
С, то есть около 10% по массе) с образованием гидратов SО2
.
nH2
O. Раствор имеет кислую реакцию, но в индивидуальном виде H2
SO3
не выделена из-за ее термодинамической неустойчивости.
Восстановительные свойства SО2
обусловлены присутствием в его молекуле неподеленной электронной пары. SО2
взаимодействует с окислителями различной силы (свободные галогены, хлорная, бромная и иодная вода; растворы KMnO4
,HNO3
, H2
SeO3
и др.), образуя различные производные S(VI):
I2
+ SO2
+ 2H2
O = 2HI +H2
SO4
,
5SO2
+ 2KMnO4
+ 2H2
O → 2MnSO4
+ K2
SO4
+ 2H2
SO4
H2
SeO3
+ 2SO2
+ H2
O  Se Se + 2H2
SO4
. + 2H2
SO4
.
SO2
+ 2HNO3
→ H2
SO4
+ 2NO2
Важнейший процесс для химической промышленности и экологии - окисление SO2
кислородом до SO3
:
SO2
+1/2O2
 SO3
, SO3
,
в технике осуществляется при повышенной температуре с использованием катализатора :
V2
O5
+ К2
O.
При отсутствии воды выше 210о
С диоксид серы реагирует с NO2
с образованием нитрозилдисерной кислоты (NO)2
S2
O7
:
2NO2
 2NO + О2
, 2NO + О2
,
2SO2
+ О2
 2SO3
, 2SO3
,
2SO3
+ NO2
+ NO  (NO)2
S2
O7
. (NO)2
S2
O7
.
В присутствии следов воды на стенках колбы обнаруживаются Н2
SO4
и NOНSO4
:
3NO2
+ 2SO2
+ H2
O  2NOHSO4
+ NO . 2NOHSO4
+ NO .
Нитрозилсерная кислота разлагается :
2NOHSO4
+ Н2
О  2H2
SO4
+ NO + NO2
. 2H2
SO4
+ NO + NO2
.
Ранее этот процесс использовался для получения серной кислоты.
При взаимодействии с более слабыми окислителями SО2
может окисляться до других степеней окисления. Например, при пропускании SО2
через взвесь MnO2
в воде образуется дитионат MnS2
O6
, производное серы(V).
2SO2
+ MnO2
→ MnS2
O6
,
Окислительные свойства SО2
проявляются при взаимодействии с сильными восстановителями, например, H2
S :
2 H2
S(г)
+ SО2(г)
=3S + 2H2
O(г)
. + 2H2
O(г)
.
С этим процессом связано образование свободной серы при вулканических процессах.
SO2
диспропорционирует в щелочном растворе с образованием сульфатов и сульфидов:
4SO2
+ 8KOH → 3K2
SO4
+ K2
S + 4H2
O
Взвесь пыли металлического цинка в воде восстанавливает SO2
до производных серы (III) - дитионитов и дитионистой кислоты:
Zn + 2SO2
= ZnS2
O4
или 2NaHSO3
+ SO2
+ Zn =  ZnSO3
+ Na2
S2
O4
+ H2
O. ZnSO3
+ Na2
S2
O4
+ H2
O.
Наличие неподеленной электронной пары в молекуле SO2
обусловливает не только восстановительные, но и комплексообразующие свойства, в частности, образование гидратов.
Молекула SO2
служит нейтральным лигандом в многочисленных комплексах с переходными металлами, например: [RuCl(NH3
)4
(SO2
)]Cl.
Их образование протекает по донорно-акцепторному механизму, при этом молекула SO2
может присоединяться (координироваться) к атому металла через атом серы или атом кислорода и действовать как концевой (однодентатный) или мостиковый (бидентатный) лиганды.
Оксид серы (
VI
) – черный триоксид :
SО3
производится каталитическим (V2
O5
, Pt, NO) окислением SO2
при 500о
С для получения H2
SO4
. Он выделяется также при термическом распаде сульфатов металлов:
PbSO4
←→ PbO + SO3
или дисульфатов:
BaS2
O7
←→ BaSO4
+ SO3
При этом SО3
частично диссоциирует на SО2
и О2
. В лаборатории чистый SО3
получают пропусканием его над P2
O5
. Образующийся продукт присоединения (аддукт) P2
O5
.
SО3
при нагревании выделяет чистый SО3
.
Кристаллический триоксид SО3
плавится при 16о
С. Мономерная газообразная молекула SО3
имеет форму симметричного плоского треугольника с длиной связи S- O1.43˚A и не обладает дипольным моментом. Они связаны общими вершинами в циклические тримеры S3
О9
, напоминающие циклические метаполифосфаты и силикаты, или бесконечные спиральные цепи.
SО3
- одно из самых реакционноспособных соединений. Проявляет окислительные свойства. Серой и углеродом SО3
восстанавливается до SO2
:
2SO3
+ C  2SO2
+ CO2
. 2SO2
+ CO2
.
Выше 500о
С SО3
восстанавливается моноксидом СО:
SО3
+ СО  SO2
+ СО2
. SO2
+ СО2
.
Особенности взаимодействия SО3
с галогеноводородами связаны с ростом восстановительных свойств в ряду HCl- HBr- HI. Окислительные свойства SО3
усиливаются с повышением температуры. При нагревании SО3
реагирует с газообразным HCl, образуя хлорсерную кислоту HSO3
Cl. При дальнейшем повышении температуры HCl восстанавливает SО3
до SO2
с одновременным выделением Cl2
. При взаимодействии с HBr триоксид серы уже при 0о
С восстанавливается до SO2
:
2SO3
+2HBr SO2
+Br2
+Н2
SO4
. SO2
+Br2
+Н2
SO4
.
В жидком HI при -51о
С немедленно выделяется I2
, а SO3
восстанавливается до Н2
S.
Взаимодействие SО3
с газообразным Н2
S протекает с образованием SO2
, Н2
О, S. Но при ~ - 78о
С получается твердый аддукт SO3
.
Н2
S - изомер тиосерной кислоты. При проведении этой реакции в сухом эфире образуется свободная тиосерная кислота:
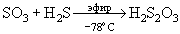
SО3
действует как сильнейшая кислота Льюиса, образуя с оксидами металлов соответствующие сульфаты:
Fe2
O3
+ 3SO3
 Fe2
(SO4
)3
. Fe2
(SO4
)3
.
и проявляет все свойства кислотных оксидов .
Серная
кислота
.
H2
SO4
— сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3
. Если молярное отношение SO3
:H2
O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO3
в серной кислоте.
Физические и химические свойства.
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % H2
SO4
. Затвердевает она лишь ниже -20 °С.
Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С).
В промышленности серную кислоту получают контактным( гетерогенный) и нитрозным ( гомогенный процесс) методами.
Химизм обоих методов одинаков и идет в несколько стадий:
4FeS2
+ 11O2
→ 2Fe2
O3
+ 8SO2
2SO2
+ O2
→ 2SO3
SO3
+ H2
O → H2
SO4
с той лишь разницей, что в контактном методе используется гетерогенный катализатор – V2
O5
– для окисления SO2
в SO3
, а в нитрозном – катализатором служит газ –NO:
NO +1
∕2
O2
→ NO2
SO2
+ NO2
→ SO3
+ NO
SO3
+ H2
O → H2
SO4
H2
SO4
- сильная двухосновная кислота.
H2
SO4
« H+
+ HSO4
-
« 2H+
+ SO4
2-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации, константа диссоциации второй ступени равна к2
= 10-2
.
Серная кислота проявляет все свойства характерные кислотам – взаимодействует с металлами, оксидами, основаниями:
Zn + H2
SO4(разб
)
® ZnSO4
+ H2
с основными оксидами:
CuO + H2
SO4
® CuSO4
+ H2
O
с гидроксидами:
H2
SO4
+ 2NaOH ® Na2
SO4
+ 2H2
O
H2
SO4
+ Cu(OH)2
® CuSO4
+ 2H2
O
обменные реакции с солями:
BaCl2
+ H2
SO4
↓ ® BaSO4
+ 2HCl
Образование белого осадка BaSO4
(нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Концентрированная серная кислота широко используется в органической химии как водоотнимающее (дегидратирующее) средство:
С11
H22
O11
+ H2
SO4
→ 12C + H2
SO4
∙ 11H2
O
HCOOH + H2
SO4
→ CO + H2
SO4
∙ H2
O
C2
H5
OH + H2
SO4
→ C2
H4
+ H2
SO4
∙ H2
O
с основными оксидами:
CuO + H2
SO4
® CuSO4
+ H2
O
с гидроксидами:
H2
SO4
+ 2NaOH ® Na2
SO4
+ 2H2
O
H2
SO4
+ Cu(OH)2
® CuSO4
+ 2H2
O
обменные реакции с солями:
BaCl2
+ H2
SO4
↓ ® BaSO4
+ 2HCl
Образование белого осадка BaSO4
(нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
с основными оксидами:
CuO + H2
SO4
® CuSO4
+ H2
O
с гидроксидами:
H2
SO4
+ 2NaOH ® Na2
SO4
+ 2H2
O
H2
SO4
+ Cu(OH)2
® CuSO4
+ 2H2
O
обменные реакции с солями:
BaCl2
+ H2
SO4
↓ ® BaSO4
+ 2HCl
Образование белого осадка BaSO4
(нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов
с основными оксидами:
CuO + H2
SO4
® CuSO4
+ H2
O
с гидроксидами:
H2
SO4
+ 2NaOH ® Na2
SO4
+ 2H2
O
H2
SO4
+ Cu(OH)2
® CuSO4
+ 2H2
O
обменные реакции с солями:
BaCl2
+ H2
SO4
↓ ® BaSO4
+ 2HCl
Образование белого осадка BaSO4
(нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Концентрированная H2
SO4
- сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до SO2
, SO или H2
S(Fe, Al, Cr – пассивируются в холодном растворе серной кислоты):
2Ag + 2H2
SO4
® Ag2
SO4
+ SO2
+ 2H2
O
8Na + 5H2
SO4
® 4Na2
SO4
+ H2
S + 4H2
O
Концентрированная H2
SO4
реагирует при нагревании с некоторыми неметаллами, превращаясь в соединения серы более низкой степени окисления:
С + 2H2
SO4
® CO2
+ 2SO2
+ 2H2
O
S + 2H2
SO4
® 3SO2
+ 2H2
O
2P + 5H2
SO4
® 5SO2
+ 2H3
PO4
+ 2H2
O
Моногидрат (чистая, 100%-ая серная кислота) является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в гидросульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза.
8.3 Селен
Селен
(Selenium), природный Селен представляет собой смесь шести устойчивых изотопов - 74
Se (0,87%), 76
Se (9,01%), 77
Se (7,58%), 78
Se (23,52%), 80
Se (49,82%), 82
Se (9,19%). Из радиоактивных изотопов наибольшее значение имеет 75
Se с периодом полураспада 121 сут. Элемент открыт в 1817 году И. Берцелиусом (название дано от греч. selene - Луна).
Природные соединения и получения
.
Селен - очень редкий и рассеянный элемент, его содержание в земной коре (кларк) 5·10-6
% по массе. История селена в земной коре тесно связана с историей серы. Селен обладает способностью к концентрации и, несмотря на низкий кларк, образует 38 самостоятельных минералов - природных селенидов, селенитов, селенатов и других. Характерны изоморфные примеси селена в сульфидах и самородной сере.
В биосфере селен энергично мигрирует. Источником для накопления селена в живых организмах служат изверженные горные породы, вулканические дымы, вулканические термальные воды. Поэтому в районах современного и древнего вулканизма почвы и осадочные породы нередко обогащены селеном .
Селен получают из отходов сернокислотного, целлюлозно-бумажного производства и анодных шламов электролитического рафинирования меди. В шламах селен присутствует вместе с серой, теллуром, тяжелыми и благородными металлами. Для извлечения селена шламы фильтруют и подвергают либо окислительному обжигу (около 700 °С), либо нагреванию с концентрированной серной кислотой. Образующийся летучий SeO2
улавливают в скрубберах и электрофильтрах. Из растворов технический селен осаждают сернистым газом. Применяют также спекание шлама с содой с последующим выщелачиванием селената натрия водой и выделением из раствора селена. Для получения селена высокой чистоты, используемого в качестве полупроводникового материала, черновой селен рафинируют методами перегонки в вакууме, перекристаллизации и другими.
Физические и химические свойства селена.
Конфигурация внешней электронной оболочки атома Se 4s2
4p4
; у двух p-электронов спины спарены, а у остальных двух - не спарены, поэтому атомы селена способны образовывать молекулы Se2
или цепочки атомов Sen
. Цепи атомов селена могут замыкаться в кольцевые молекулы Se8
. Разнообразие молекулярного строения обусловливает существование селена в различных аллотропических модификациях: аморфной (порошкообразный, коллоидный, стекловидный) и кристаллической (моноклинный α- и β-формы и гексагональный γ-формы). Аморфный (красный) порошкообразный и коллоидный селен (плотность 4,25 г/см3
при 25 °С) получают при восстановлении из раствора селенистой кислоты H2
SeO3
, быстрым охлаждением паров селена и другими способами. Стекловидный (черный) селен (плотность 4,28 г/см3
при 25 °С) получают при нагревании любой модификации селена выше 220 °С с последующим быстрым охлаждением. Стекловидный селен обладает стеклянным блеском, хрупок. Термодинамически наиболее устойчив гексагональный (серый) селен. Он получается из других форм селена нагреванием до плавления с медленным охлаждением до 180-210 °С и выдержкой при этой температуре. Решетка его построена из расположенных параллельно спиральных цепочек атомов. Атомы внутри цепей связаны ковалентно. Все модификации селена обладают фотоэлектрическими свойствами. Гексагональный селен вплоть до температуры плавления - примесный полупроводник с дырочной проводимостью. Селен - диамагнетик (пары его парамагнитны).
На воздухе селен устойчив; кислород, вода, соляная и разбавленная серная кислоты на него не действуют, хорошо растворим в концентрированной азотной кислоте и царской водке, в щелочах растворяется диспропорционируя:
Se + 4HNO3
→ H2
SeO3
+ 4NO2
+ H2
O
3Se + 6KOH → K2
SeO3
+ 2K2
Se + 3H2
O
Селен в соединениях имеет степени окисления -2, + 2, + 4, +6. С кислородом селен образует ряд оксидов: SeO, Se2
O3
, SeO2
, SeO3
. Два последних являются ангидридами селенистой H2
SeO3
и селеновой H2
SeО4
кислот (соли -селениты и селенаты). Наиболее устойчив SeO2
. SeO2
и H2
SeO3
с сильными окислителями проявляют восстановительные свойства:
3H2
SeO3
+ HClO3
→ 3H2
SeO4
+ HCl
С галогенами селен дает соединения SeF6
, SeF4
, SeCl4
, SeBr4
, Se2
Cl2
и другие. Сера и теллур образуют непрерывный ряд твердых растворов с селеном. С азотом селен дает Se4
N4
, с углеродом -CSe2
. Известны соединения с фосфором Р2
Sе3
, Р4
Sе3
, P2
Se5
. Водород взаимодействует с селеном при t>=200 °С, образуя H2
Se; раствор H2
Se в воде называется селеноводородной кислотой. При взаимодействии с металлами селен образует селениды. Получены многочисленные комплексные соединения селена. Все соединения селена ядовиты.
Применение селена
.
Благодаря дешевизне и надежности селен используется в преобразовательной технике в выпрямительных полупроводниковых диодах, а также для фотоэлектрических приборов (гексагональный), электрофотографических копировальных устройств (аморфный селен), синтеза различных селенидов, в качестве люминофоров в телевидении, оптических и сигнальных приборах, терморезисторах и т. п. селен широко применяется для обесцвечивания зеленого стекла и получения рубиновых стекол; в металлургии - для придания литой стали мелкозернистой структуры, улучшения механических свойств нержавеющих сталей; в химической промышленности - в качестве катализатора; используется селен также в фармацевтической промышленности и других отраслях.
8.4 Теллур
Природные соединения и получение.
Основные. источники теллура-шламы электролитического рафинирования меди и шламы сернокислотного производства, а также щелочные дроссы рафинирования свинца . При переработке сернокислотных шламов методом обжига (см. Селен)теллур остается в огарке, который выщелачивают соляной кислотой. Из солянокислого раствора пропусканием SO2
осаждают Se, после чего р-р разбавляют до содержания кислоты 10-12% и при нагревании действием SO2
осаждают теллур.
При спекании шламов с содой и последующим выщелачивании теллур переходит в р-р и при нейтрализации осаждается в виде ТеО2
. Теллур получают либо прямым восстановлением ТеО2
углем, либо осаждением при действии SO2
на солянокислые растворы ТеО2
. При переработке шламов сульфидным методом (выщелачивание раствором Na2
S) теллур выделяют из раствора (после осаждения Se аэрацией) действием сухого Na2
S2
O3
:
Na2
TeS3
+ 2Na2
SO3
→ Те + 2Na2
S2
O3
+ Na2
S
При переработке медеэлектролитных шламов теллур в основном переходит в содовые шлаки, получающиеся при переплавке остатков на золото-серебряный сплав ("металл Дорэ"). При использовании сульфатизации часть теллура переходит в сульфатные растворы вместе с Си. Из них теллур осаждают действием металлической меди:
Н2
ТеО3
+ 4H2
SO4
+ 6Сu → Те + Си2
Те + 4CuSO4
+ 6Н2
О
Из содовых шлаков теллур извлекают после растворения в воде либо нейтрализацией с осаждением ТеО2
(его очищают переосаждением из сульфидных или кислых растворов, растворяют в щелочи и выделяют теллур электролизом), либо прямо из содового раствора электролизом осаждают черновой теллур. Его восстанавливают А1 в щелочном растворе:
6Те + 2А1 + SNaOH → 3Na2
Te2
+ 2NaAlO2
+ 4Н2
О. Затем теллур осаждают аэрацией:
2Na2
Te2
+ 2Н2
О + О2
→ 4Те + 4NaOH
Для получения теллура высокой чистоты используют его летучие соединения, в частности ТеСl4
, который очищают дистилляцией или ректификацией и экстракцией из солянокислого раствора. После гидролиза хлорида ТеО2
восстанавливают Н2
. Иногда для очистки используют также Н2
Те. На завершающих стадиях очистки применяют вакуумную сублимацию, дистилляцию или ректификацию теллура, а также зонную плавку или направленную кристаллизацию.
Физические и химические свойства.
Теллур-серебристо-серое вещество с металлическим блеском, в тонких слоях на просвет-красно-коричневого цвета, в парах-золотисто-желтый. Расплав теллура выше ~ 700 °С обладает металлической проводимостью. Теллур диамагнитен, магн. восприимчивость — 0,31·10-9
. Твердость по Моосу 2,3, по Бринеллю 180-270 МПа; сопротивление разрыву 10,8 МПа. Теллур хрупок, при нагревании становится пластичным.
Для теллура нормальный электродный потенциал 0,56 В. Теллур, даже дисперсный, устойчив на воздухе, но при нагревании горит (пламя голубое с зеленым ореолом) с образованием ТеО2
. Кристаллический теллур реагирует с водой выше 100°С, аморфный-выше 50 °С. Концентрированные растворы щелочей растворяют теллур с образованием теллуридов и теллуритов. Соляная кислота и разбавленная H2
SO4
на теллур не действуют, конц. H2
SO4
растворяет его, образующиеся красные растворы содержат катион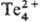 . HNO3
окисляет теллур до теллуристой кислоты Н2
ТеО3
(соли-теллуриты): . HNO3
окисляет теллур до теллуристой кислоты Н2
ТеО3
(соли-теллуриты):
Te + HNO3
→ H2
TeO3
+ 4NO2
+ H2
O
Сильными окислителями (HСlО3
, КМnО4
и др.) окисляется до теллуровой кислоты Н2
ТеО4
(соли-теллураты):
4Te + 3HClO4
+ 4H2
O → 4H2
TeO4
+ 3HCl
Te + 3H2
O2
→ H2
TeO4
+ 2H2
O
Теллур растворяется в растворах сульфидов и полисульфидов щелочных металлов (с образованием тиотеллуридов и тио-теллуритов). Реагирует с растворами солей Ag. В CS2
не растворяется. С Сl2
, F2
и Вr2
реагирует при комнатной т-ре, с I2
-при нагревании, сплавляется с S, P (соединений при этом не образует), As (давая As2
Te3
), с Si (с образованием Si2
Te3
и SiTe), с Se (образуя при кристаллизации твердые растворы). С бором и углеродом непосредственно не взаимодействует, с СО при нагревании образует газообразный нестойкий карбонил ТеСО. При сплавлении с металлами получают теллуриды.
Теллуроводород Н2
Те-бесцветный газ с неприятным запахом; в жидком состоянии зеленовато-желтый, кристаллический-лимонно-желтый; т. кип. — 2°С, т. пл. — 51 °С; плотн. 5,81 г/л; для газа; а в сухом воздухе при комнатной температуре медленно разлагается, во влажном окисляется до теллура; при нагревании на воздухе горит, давая ТеО2
; растворимость в воде 0,1 М, водный раствор-слабая кислота, К1
2·10-3
; сильный восстановитель; получают взаимодействием Аl2
Те3
с соляной кислотой, а также электролизом раствора H2
SO4
с теллуровым катодом при 0°С; применяют для получения теллура высокой чистоты.
Гексафторид ТеF6
-бесцветный газ; т. пл. — 37,8°С, т. возг. -38,6°С; плотн. 10,7 г/л; в сухом воздухе устойчив, не действует на стекло; в воде растворяется, постепенно гидролизуясь с образованием фторотеллуровых кислот ТеFn
(ОН)6-n
, где n — от 1 до 4, и в конечном счете теллуровой кислоты; с фторидами металлов образует соединения , напр. Ag[TeF7
] и Ba[TeF8
]; получают фторированием теллура при нагревании. Тетрафторид TeF4
-кристаллы ромбической сингонии; т. пл. 129,6°С, т. кип. 194°С (с разложением); плотность 4,22 г/см3
; очень гигроскопичен, легко гидролизуется; с фторидами щелочных металлов образует пентафторотеллураты M[TeF5
]; получают действием SeF4
на ТеО2
. Фториды теллурафторирующие агенты.
Тетрахлорид ТеС14
-желтые кристаллы; т. пл. 224°С, т. кип. 381,8°С; плотн. 3,01 г/см3
; ур-ние температурной зависимости давления пара \gp (мм рт. ст.) = 8,791 — - 3941/T (497 – 653); очень гигроскопичен, водой гидролизуется; в концентрированной НС1 раств., образуя хлоротел-луровую кислоту Н2
ТеС16
; из солянокислых растворов экстрагируется трибутилфосфатом и другими органическими растворителями ; с хлоридами щелочных металлов образует гекса- М2
[ТеСl6
] и пентахлортел-лураты М[ТеС15
], с хлоридами Al, Fe(III), Zr и другие комплексы с катионами, например, ТеС13
[GaCl4
]; получают хлорированием теллура; ТеСl4
-исходное вещество для получения теллура высокой чистоты. Коричневый дихлорид ТеС12
устойчив в парах и может быть сконденсирован в жидкость. Получены также два кристаллических низших хлорида-серебристо-серый Те2
Сl3
и метастабильный черный с металлическим блеском Те2
Сl.
Осаждением из водных р-ров можно получить сульфиды TeS2
и TeS3
, разлагающиеся при нагревании; известны TeS7
и Te7
S10
. Тиотеллураты (напр., Na2
TeS3
) могут быть получены растворением теллура в растворе полисульфидов щелочных металлов или сере -в растворах полителлуридов, а также сплавлением. Тиотеллураты-промежуточные продукты в некоторых процессах извлечения теллура.
Применение.
Важнейшая область применения теллура—синтез разложения теллуридов, обладающих полупроводниковыми свойствами. Теллур используют также в металлургии для легирования чугуна и стали, Рb, Сu (для повышения их механической и химической стойкости). Теллур и его соединения применяют в производстве катализаторов, спец. стекол, инсектицидов, гербицидов и т.п.
Полоний
Природные соединения и получение полония.
Радиоактивный химический элемент VI группы периодической системы, аналог теллура. Атомный номер 84. Не имеет стабильных изотопов. Известно 27 радиоактивных изотопов полония с массовыми числами от 192 до 218, из них семь (с массовыми числами от 210 до 218) встречаются в природе в очень малых количествах как члены радиоактивных рядов урана, тория и актиния, остальные изотопы получены искусственно. Наиболее долгоживущие изотопы полония – искусственно полученные 209
Ро (t
1/2
= 102 года) и 208
Ро (t
1/2
= 2,9 года), а также содержащийся в радиево-урановых рудах 210
Ро (t
1/2
= 138,4 сут). Содержание в земной коре 210
Ро составляет всего 2·10–14
%; в 1 т природного урана содержится 0,34 г радия и доли миллиграмма полония-210. Самый короткоживущий из известных изотопов полония – 21З
Ро (t
1/2
= 3·10–7
с). Самые легкие изотопы полония – чистые альфа-излучатели, более тяжелые одновременно испускают альфа- и гамма-лучи. Некоторые изотопы распадаются путем электронного захвата, а самые тяжелые проявляют также очень слабую бета-активность . Разные изотопы полония имеют исторические названия, принятые еще в начале 20 в., когда их получали в результате цепочки распадов из «родительского элемента»: RaF (210
Po), AcC" (211
Po), ThC" (212
Po), RaC" (214
Po), AcA (215
Po), ThA (216
Po), RaA (218
Po).
Полоний-210 синтезируют путем облучения нейтронами природного висмута (он содержит только 208
Bi) в ядерных реакторах (промежуточно образуется бета-активный изотоп висмута-210): 208
Bi + n→210
Bi → 210
Po + e. При облучении висмута ускоренными протонами образуется полоний-208, его отделяют от висмута возгонкой в вакууме – как это делала М.Кюри. В СССР методику выделения полония разработала Зинаида Васильевна Ершова (1905–1995). В 1937 она была командирована в Париж в Институт радия в лабораторию М.Кюри (руководимую в то время Ирэн Жолио-Кюри). В результате этой командировки коллеги стали называть ее «русской мадам Кюри». Под научным руководством З.В.Ершовой в стране было создано постоянно действующее, экологически чистое производство полония, что позволило реализовать отечественную программу запуска луноходов, в которых полоний использовали в качестве источника тепла.
Долгоживущие изотопы полония пока не получили заметного практического применения из-за сложности их синтеза. Для их получения можно использовать ядерные реакции
207
Pb + 4
He ® 208
Po + 3n,
208
Bi + 1
H ® 208
Po + 2n,
208
Bi + 2
D ® 208
Po + 3n,
208
Bi + 2
D ® 208
Po + 2n,
где 4
Не – альфа-частицы, 1
Н – ускоренные протоны, 2
D – ускоренные дейтроны (ядра дейтерия).
Свойства полония.
Уже теллур частично проявляет металлические свойства, полоний же – мягкий серебристо-белый металл. Из-за сильной радиоактивности светится в темноте и сильно нагревается, поэтому нужен непрерывный отвод тепла. Температура плавления полония 254° С (чуть выше, чем у олова), температура кипения 962° С, поэтому уже при небольшом нагревании полоний возгоняется. Плотность полония почти такая же, как у меди – 9,4 г/см3
. В химических исследованиях применяется только полоний-210, более долгоживущие изотопы практически не используются ввиду трудности их получения при одинаковых химических свойствах.
Химические свойства металлического полония близки к свойствам его ближайшего аналога – теллура, он проявляет степени окисления –2, +2, +4, +6. На воздухе полоний медленно окисляется (быстро при нагревании до 250° С) с образованием красного диоксида РоО2
(при охлаждении он становится желтым в результате перестройки кристаллической решетки). Сероводород из растворов солей полония осаждает черный сульфид PoS.
Сильная радиоактивность полония отражается на свойствах его соединений. Так, в разбавленной соляной кислоте полоний медленно растворяется с образованием розовых растворов (цвет ионов Ро2+
):
Po + 2HCl ® PoCl2
+ H2
,
однако под действием собственной радиации дихлорид превращается в желтый PoCl4
. Разбавленная азотная кислота пассивирует полоний, а концентрированная быстро его растворяет:
Po + 8HNO3
→ Po(NO3
)4
+ 4NO2
+ 4H2
O
С неметаллами VI группы полоний роднит реакция с водородом с образованием летучего гидрида РоН2
(т.пл. –35° С, т.кип. +35° С, легко разлагается), реакция с металлами (при нагревании) с образованием твердых полонидов черного цвета (Na2
Po, MgPo, CaPo, ZnPo, HgPo, PtPo и др.) и реакция с расплавленными щелочами с образованием полонидов:
3Po + 6NaOH ® 2Na2
Po + Na2
PoO3
+ H2
O.
С хлором полоний реагирует при нагревании с образованием ярко-желтых кристаллов PoCl4
, с бромом получаются красные кристаллы PoBr4
, с иодом уже при 40° С полоний реагирует с образованием черного летучего иодида PoI4
. Известен и белый тетрафторид полония PoF4
. При нагревании тетрагалогениды разлагаются с образованием более стабильных дигалогенидов:
PoCl4
® PoCl2
+ Cl2
.
В растворах полоний существует в виде катионов Ро2+
, Ро4+
, анионов РоО3
2–
, РоО4
2–
, также разнообразных комплексных ионов, например, PoCl6
2–
.
Применение полония.
Полоний-210 испускает альфа-лучи с энергией 5,3 МэВ, которые в твердом веществе тормозятся, проходя всего тысячные доли миллиметра и отдавая при этом свою энергию. Время его жизни позволяет использовать полоний как источник энергии в атомных батареях космических кораблей: для получения мощности 1 кВт достаточно всего 7,5 г полония. В этом отношении он превосходит другие компактные «атомные» источники энергии. Такой источник энергии работал, например, на «Луноходе-2», обогревая аппаратуру во время долгой лунной ночи. Конечно, мощность полониевых источников энергии со временем убывает – вдвое каждые 4,5 месяца, однако более долгоживущие изотопы полония слишком дороги. Полоний удобно применять и для исследования воздействия альфа-излучения на различные вещества. Как альфа-излучатель, полоний в смеси с бериллием применяют для изготовления компактных источников нейтронов:
9
Be + 4
He ® 12
C + n.
Вместо бериллия в таких источниках можно использовать бор. Сообщалось, что в 2004 инспекторы международного агентства по атомной энергии (МАГАТЭ) обнаружили в Иране программу по производству полония. Это привело к подозрению, что он может быть использован в бериллиевом источнике для «запуска» с помощью нейтронов цепной ядерной реакции в уране, приводящей к ядерному взрыву.
Полоний при попадании в организм можно считать одним из самых ядовитых веществ: для 210
Ро предельно допустимое содержание в воздухе составляет всего 40 миллиардных долей микрограмма в 1 м3
воздуха, т.е. полоний в 4 триллиона раз токсичнее синильной кислоты. Вред наносят испускаемые полонием альфа-частицы (и в меньшей мере также гамма-лучи), которые разрушают ткани и вызывают злокачественные опухоли. Атомы полония могут образоваться в легких человека в результате распада в них газообразного радона. Кроме того, металлический полоний способен легко образовывать мельчайшие частицы аэрозолей. Поэтому все работы с полонием проводят дистанционно в герметичных боксах.
Открытие полония.
Существование элемента с порядковым номером 84 было предсказано Д.И.Менделеевым в 1889 – он назвал его двителлуром (на санскрите – «второй» теллур) и предположил, что его атомная масса будет близка к 212. Конечно, Менделеев не мог предвидеть, что этот элемент окажется неустойчивым. Полоний – первый радиоактивный элемент, открытый в 1898 супругами Кюри в поисках источника сильной радиоактивности некоторых минералов. Когда оказалось, что урановая смоляная руда излучает сильнее, чем чистый уран, Мария Кюри решила выделить из этого соединения химическим путем новый радиоактивный химический элемент. До этого было известно только два слабо радиоактивных химических элемента – уран и торий. Кюри начала с традиционного качественного химического анализа минерала по стандартной схеме, которая была предложена немецким химиком-аналитиком К.Р.Фрезениусом (1818–1897) еще в 1841 и по которой многие поколения студентов в течение почти полутора веков определяли катионы так называемым «сероводородным методом». Вначале у нее было около 100 г минерала; затем американские геологи подарили Пьеру Кюри еще 500 г. Проводя систематический анализ, М.Кюри каждый раз проверяла отдельные фракции (осадки и растворы) на радиоактивность с помощью чувствительного электрометра, изобретенного ее мужем. Неактивные фракции отбрасывались, активные анализировались дальше. Ей помогал один из руководителей химического практикума в Школе физики и промышленной химии Густав Бемон.
Прежде всего, Кюри растворила минерал в азотной кислоте, выпарила раствор досуха, остаток растворила в воде и пропустила через раствор ток сероводорода. При этом выпал осадок сульфидов металлов; в соответствии с методикой Фрезениуса, этот осадок мог содержать нерастворимые сульфиды свинца, висмута, меди, мышьяка, сурьмы и ряда других металлов. Осадок был радиоактивным, несмотря на то, что уран и торий остались в растворе. Она обработала черный осадок сульфидом аммония, чтобы отделить мышьяк и сурьму – они в этих условиях образуют растворимые тиосоли, например, (NH4
)3
AsS4
и (NH4
)3
SbS3
. Раствор не обнаружил радиоактивности и был отброшен. В осадке остались сульфиды свинца, висмута и меди.
Не растворившуюся в сульфиде аммония часть осадка Кюри снова растворила в азотной кислоте, добавила к раствору серную кислоту и выпарила его на пламени горелки до появления густых белых паров SO3
. В этих условиях летучая азотная кислота полностью удаляется, а нитраты металлов превращаются в сульфаты. После охлаждения смеси и добавления холодной воды в осадке оказался нерастворимый сульфат свинца PbSO4
– радиоактивности в нем не было. Осадок она выбросила, а к отфильтрованному раствору добавила крепкий раствор аммиака. При этом снова выпал осадок, на этот раз – белого цвета; он содержал смесь основного сульфата висмута (BiO)2
SO4
и гидроксида висмута Bi(OH)3
. В растворе же остался комплексный аммиакат меди [Cu(NH3
)4
]SO4
ярко-синего цвета. Белый осадок, в отличие от раствора, оказался сильно радиоактивным. Поскольку свинец и медь были уже отделены, в белом осадке был висмут и примесь нового элемента.
Кюри снова перевела белый осадок в темно-коричневый сульфид Bi2
S3
, высушила его и нагрела в вакуумированной ампуле. Сульфид висмута при этом не изменился (он устойчив к нагреву и лишь при 685° С плавится), однако из осадка выделились какие-то пары, которые осели в виде черной пленки на холодной части ампулы. Пленка была радиоактивной и, очевидно, содержала новый химический элемент – аналог висмута в периодической таблице. Это был полоний – первый после урана и тория открытый радиоактивный элемент, вписанный в периодическую таблицу (в том же 1898 году были открыты радий, а также группа благородных газов – неон, криптон и ксенон). Как потом выяснилось, полоний при нагревании легко возгоняется – его летучесть примерно такая же, как у цинка.
Супруги Кюри не спешили назвать черный налет на стекле новым элементом. Одной радиоактивности было мало. Коллега и друг Кюри французский химик Эжен Анатоль Демарсе (1852–1903), специалист в области спектрального анализа (в 1901 он открыл европий), исследовал спектр испускания черного налета и не обнаружил в нем новых линий, которые могли бы свидетельствовать о присутствии нового элемента. Спектральный анализ – один из самых чувствительных методов, позволяющий обнаруживать многие вещества в микроскопических, невидимых глазом количествах. Тем не менее, в статье, опубликованной 18 июля 1898 супруги Кюри написали: «Мы думаем, что вещество, выделенное нами из урановой смолки, содержит не известный пока металл, являющийся по аналитическим свойствам аналогом висмута. Если существование нового металла будет подтверждено, мы предлагаем назвать его полонием, по родине одного из нас» (Polonia на латыни – Польша). Это единственный случай, когда еще не идентифицированный новый химический элемент уже получил название. Однако получить весовые количества полония не удалось – его в урановой руде было слишком мало (позднее полоний был получен искусственно). И прославил супругов Кюри не этот элемент, а радий.
|