| Проект
Государственная (итоговая) аттестация 2010 года (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные программы
Демонстрационный вариант
контрольных измерительных материалов для проведения в 2011 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные программы основного общего образования
| Химия. 9 класс
Проект
Демонстрационный вариант
контрольных измерительных материалов для проведения в 2011 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные программы основного общего образования
Пояснения к демонстрационному варианту экзаменационной работы
При ознакомлении с демонстрационным вариантом 2011 года следует иметь в виду, что задания, включенные в демонстрационный вариант, не
отражают всех элементов содержания, которые будут проверяться с
помощью вариантов КИМ в 2011 году
. Полный перечень элементов содержания, которые могут контролироваться на экзамене 2011 года, приведен в кодификаторе, размещенном на сайте www.fipi.ru.
Демонстрационный вариант предназначен для того, чтобы дать возможность любому участнику экзамена и широкой общественности составить представление о структуре будущей экзаменационной работы, числе и форме заданий, а также их уровне сложности. Приведенные критерии оценивания выполнения заданий с развернутым ответом, включенные в этот вариант, позволят составить представление о требованиях к полноте и правильности записи развернутого ответа.
Эти сведения дают выпускникам возможность выработать стратегию подготовки к сдаче экзамена по химии.
2
|
подготовлен Федеральным государственным научным учреждением «ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»
1
Демонстрационный вариант 2011 года
Инструкция по выполнению работы
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 3 частей, содержащих 22 задания.
Часть 1 содержит 15 заданий (А1–А15). К каждому заданию дается 4 варианта ответа, из которых только один правильный. При выполнении задания части 1 обведите кружком номер
выбранного ответа в экзаменационной работе. Если вы обвели не тот номер, то зачеркните обведенный номер крестом, а затем обведите номер правильного ответа.
Часть 2 состоит из 4 заданий (В1–В4), на которые нужно дать краткий ответ в виде набора цифр. Для заданий части 2 ответ записывается в экзаменационной работе в отведенном для этого месте. В случае записи неверного ответа зачеркните его и запишите рядом новый.
Часть 3 включает 3 задания (С1, С2, С3), выполнение которых предполагает написание полного, развернутого ответа, включающего необходимые уравнения реакций и расчеты. Ответы на задания части 3 записываются на отдельном листе.
| Химия. 9 класс
Часть 1
| К каждому из заданий A1–A19 даны 4 варианта ответа, из которых только один правильный. Номер правильного ответа обведите кружком.
|
Атому какого химического элемента соответствует приведенная ниже схема строения?
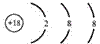
1) аргона
2) кислорода
3) серы
4) кальция
От кислотных к оснóвным меняются свойства оксидов в ряду
1) CaO → SiO2
→ SO3
2) CO2
→ Al2
O3
→ MgO
3) SO3
→ P2
O5
→ Al2
O3
4) Na2
O → MgO → Al2
O3
Какой вид химической связи в молекуле аммиака?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
Такую же степень окисления, как и в SO2
, сера имеет в соединении
1) K2
SO4
2) H2
SO3
3) (NH4
)2
S 4) SO3
Оснóвным оксидом и кислотой, соответственно, являются
1) FeO, Ba(OН)2
2) K2
O, (NH4
)2
S
3) MgO, H2
SO4
4) SO2
, HNO3
4
|
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. Если после выполнения всей работы у вас останется время, вы сможете вернуться к пропущенным заданиям.
За каждый правильный ответ в зависимости от сложности задания и полноты ответа дается один или более баллов. Баллы, полученные вами за все выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать максимально возможное количество баллов.
Желаем успеха!
3
К химическим явлениям относится процесс
1) измельчения сахара до состояния пудры 2) превращения воды в лед
3) появления капель воды на крышке чайника
4) горения свечи
Наименьшее число ионов образуется в растворе при полной диссоциации
1 моль
1) FeCl3
2) Na2
S 3) KNO3
4) BaCl2
Сокращенному ионному уравнению Ba2+
+ SO4
2-
= BaSO4
↓ соответствует левая часть схемы химической реакции
1) BaСl2
+ H2
SO4
→
2) BaCO3
+ Na2
SO4
→
3) BaO + SO3
→
4) Ba + H2
SO4
→
И литий, и железо при комнатной температуре реагируют с
| Химия. 9 класс
И нитрат аммония, и нитрат цинка могут взаимодействовать с
1) гидроксидом калия
2) раствором хлорида натрия
3) раствором серной кислоты
4) железом
Верны ли следующие суждения о правилах хранения витаминов и предназначении моющих средств?
А. Хранение витаминов не требует строгого соблюдения указанных в инструкции правил.
Б. Для удаления жирных пятен с поверхности посуды целесообразно использовать моющие средства, имеющие щелочную среду.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В приборе, изображённом на рисунке,

получают и подтверждают наличие
1) аммиака
2) водорода
3) кислорода
4) азота
Массовая доля азота в нитрате цинка равна
1) 7,4%
2) 11,0%
3) 14,8%
4) 22,2%
6
|
1) гидроксидом натрия
2) водой
3) серой
4) соляной кислотой
Химическая реакция возможна между
1) оксидом фосфора(V) и оксидом калия 2) оксидом алюминия и водой
3) оксидом кремния и соляной кислотой
4) оксидом цинка и кислородом
Раствор гидроксида бария не реагирует
с
1) железом
2) оксидом серы(VI)
3) сульфатом натрия
4) фосфорной кислотой
5
Часть 2
| При выполнении заданий В1 и В2 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов.
|
В ряду химических элементов Si – Ge – Sn
1) увеличивается число электронных слоев 2) уменьшается число протонов в ядре
3) увеличивается значение электроотрицательности 4) усиливается оснóвный характер высших оксидов
5) увеличивается число электронов во внешнем слое
Ответ:___________________________
Метан
1) является составной частью природного газа
2) относится к непредельным углеводородам
3) хорошо растворяется в воде
4) не реагирует с кислородом
| Химия. 9 класс
Установите соответствие между веществом и реагентами, с которыми оно может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ
A) железо 1) K2
O, Mg
Б) оксид углерода(IV) 2) Na2
SO4
, HNO3
В) гидроксид натрия 3) HCl, O2
4) CuSO4
, Al(OH)3
Ответ:
Часть 3
| Для ответов на задания C1–C2 используйте отдельный лист. Запишите сначала номер задания (С1 или С2), а затем ответ к нему.
|
Дана схема превращений:
Cu → Cu(NO3
)2
→ X t
°
 CuO CuO
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
На занятиях химического кружка учащиеся исследовали кристаллическое вещество белого цвета.
В результате добавления к нему гидроксида калия и последующего нагревания полученной смеси выделился газ с резким специфическим запахом, при горении которого образуется азот. После растворения исследуемого вещества в воде и приливания к нему раствора нитрата серебра образовался осадок белого цвета, не растворимый в кислотах.
Определите состав неизвестного вещества и запишите 3 уравнения реакций, которые были проведены учащимися в процессе его распознавания.
8
|
5) вступает в реакцию с хлором
Ответ:___________________________
| При выполнении заданий B3 и В4 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите в таблицу под соответствующими буквами.
|
Установите соответствие между схемой превращения и изменением степени
| окисления окислителя в ней.
|
|
| СХЕМА ПРЕВРАЩЕНИЙ
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
|
| A) Cl2
+ K2
MnO4
→ KMnO4
+ KCl
|
1) Э+6
→ Э+7
|
| Б) NH4
Cl + KNO3
→ KCl + N2
O + H2
O
|
2) Э+5
→ Э+1
|
| В) HI + FeCl3
→ FeCl2
+ HCl + I2
|
3) Э+3
→ Э+2
|
| |
4) Э0
→ Э-1
|
| |
5) Э-1
→ Э0
|
Ответ:
7
Система оценивания экзаменационной работы по химии
Части 1 и 2
Верное выполнение каждого задания Части 1
(А1–А19) оценивается 1 баллом. За выполнение задания с выбором ответа выставляется 1 балл при условии, что указан только один номер правильного ответа. Если отмечены два и более ответов, в том числе правильный, то ответ не засчитывается.
В Части 2
задание с кратким ответом считается выполненным верно, если в заданиях В1–В4 правильно указана последовательность цифр. За полный правильный ответ на задания В1–В4 ставится 2 балла, если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов.
| Химия. 9 класс
| Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
|
| Написаны уравнения реакций, соответствующие схеме превращений:
1) Cu + 4HNO3
= Cu(NO3
)2
+ 2NO2
+ 2H2
O
2) Cu(NO3
)2
+ 2NaOH = Cu(OH)2
+ 2NaNO3
3) Cu(OH)2
t
°
 CuO + H2
O CuO + H2
O
4) Составлено сокращенное ионное уравнение для второго превращения:
2OH-
+ Cu2+
= Cu(OH)2
|
| Критерии оценивания
|
Баллы
|
| Ответ правильный и полный, включает все названные элементы.
|
4
|
| Правильно записаны 3 уравнения реакций.
|
3
|
| Правильно записаны 2 уравнения реакций.
|
2
|
| Правильно записано 1 уравнение реакции.
|
1
|
| Все элементы ответа записаны неверно.
|
0
|
| Максимальный балл
|
4
|
После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
| Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
|
| 1) Составлено уравнение реакции: СО2
+ 2КOH = К2
CO3
+ H2
O
2) Рассчитано количество вещества карбоната калия, полученного в результате реакции:
n (СО2
) = V (СО2
)/ Vm
= 1,12 : 22,4 = 0,05 моль по уравнению реакции n(К2
СО3
) = n(СО2
) = 0,05 моль
3) Определена массовая доля карбоната натрия в растворе:
m (К2
СО3
) = n (К2
СО3
) · M(К2
СО3
) = 0,05 · 138 = 6,9 г
ω (К2
СО3
)= m (К2
СО3
) · 100 : m (р-ра К2
СО3
) = 6,9 · 100:138 = 5%
|
| Критерии оценивания
|
Баллы
|
| Ответ правильный и полный, включает все названные элементы.
|
3
|
| Правильно записаны 2 элемента из названных выше.
|
2
|
| Правильно записан 1 из названных выше элементов (1-й или 2-й).
|
1
|
| Все элементы ответа записаны неверно.
|
0
|
| Максимальный балл
|
3
|
10
|
| № задания
|
Ответ
|
№ задания
|
Ответ
|
| А1
|
1
|
А11
|
1
|
| А2
|
2
|
А12
|
1
|
| А3
|
2
|
А13
|
2
|
| А4
|
2
|
А14
|
3
|
| А5
|
3
|
А15
|
3
|
| А6
|
4
|
В1
|
14
|
| А7
|
3
|
В2
|
15
|
| А8
|
1
|
В3
|
423
|
| А9
|
4
|
В4
|
314
|
| А10
|
1
|
|
|
Часть 3
Критерии оценивания выполнения заданий с развернутым ответом
Дана схема превращений:
Cu → Cu(NO3
)2
→ X t
°
 CuO CuO
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
9
На занятиях химического кружка учащиеся исследовали кристаллическое вещество белого цвета.
В результате добавления к нему гидроксида калия выделился газ с резким специфическим запахом, при горении которого на воздухе образуется азот. После растворения исследуемого вещества в воде и приливания к нему раствора нитрата серебра образовался осадок белого цвета, не растворимый в кислотах.
Запишите 3 уравнения реакций, которые были проведены учащимися в процессе распознавания неизвестного вещества.
| Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
|
| Составлены уравнения реакций, проведенных учащимися в процессе исследования неизвестного вещества:
1) NH4
Cl + КOH = КCl + NH3
+ H2
O
2) 4NH3
+ 3O2
= 2N2
+ 6H2
O
3) NH4
Cl + AgNO3
= AgCl + NH4
NO3
|
| Критерии оценивания
|
Баллы
|
| Ответ правильный и полный, включает все названные элементы.
|
3
|
| Правильно записаны 2 уравнения реакций.
|
2
|
| Правильно записано 1 уравнение реакции.
|
1
|
| Все элементы ответа записаны неверно.
|
0
|
| Максимальный балл
|
3
|
11
|