|
Де Р – рідина; Т – тверда речовина; Г - газ. Наприклад, це спирт вода, ацетон вода; це цементний розчин, вапняний розчин. це – газована вода, лимонад; це однорідні сплави (бронза мідь – олово, латунь мідь – цинк, сплави золота, срібла); це кристалогідрати: ( це повітря в активованому вугіллі, у вапняних породах; це повітря; це дим, пильні бурі; це туман. По величині частинок розчини бувають: Істинні – величина частинок < 1н/м (мілімікрон) . Наприклад, розчин хлориду натрію, цукру у воді. 2.
Колоїдні
Наприклад, колоїдні розчини срібла, кров, канцелярський клей. 3. Зависі –––– –––– від 100 і більше н/м „ Зависі в свою чергу діляться на суспензії та емульсії. Суспензії – завись твердої речовини в рідині. Наприклад, цементний розчин, вапняний розчин. Емульсії - завись рідини в рідині. Масло в воді. Існують дві теорії розчинів: Теорія Д.І. Менделєєва , яка заключається в тому , що розчинна речовина взаємодіє з розчинником. Ця теорія ще називається хімічна, гідратна, сольватна. ↔ Теорія Арреніуса , яка доказує що розчинник являється індиферентним по відношенню до речовин, тобто не реагує з речовиною. Цемент, крейда, вапно. І та і друга заслуговують уваги. Що в такому разі представляють розчини: фізичну суміш чи хімічну сполуку? Виявляється вони одночасно являються і тими і другими.
1. Істинні розчини утворюються самовільно (спонтанно) при простому зіткненню рідини і речовини. 2. Між рідиною і речовиною може пройти реакція → ↑ → 3. Істинні розчини стійки. 4. Істинні розчини однорідні. 5. При розчиненні часто об„єм зменшується. Спирт – вода 50 мл + 50 мл = 9 мл Розглянемо процес розчинення. Для того, щоб перевести кристалічну речовину в розчин, треба затратити роботу по подоланню сил, які з„єднують молекули в кристал, тобто затратити енергію, щоб зруйнувати кристалічну решітку. У цьому разі необхідно щоб розчинник мав взаємодію з молекулами кристалу. Тобто: Коли сили взаємодії між молекулами речовини, що розчиняємо, і розчинником більші, ніж сили взаємодії між молекулами розчиненої речовини, то відбувається розчинення. Наприклад, розглянемо процес розчинення . Між іонами і СІ діють сили електростатичного тяжіння. Між молекулами води існує водневий зв„язок. Саме молекула води полярна, тому вона буде орієнтуватися своїми полюсами так, щоб негативний обволікав іони натрію , а позитивний – іон хлору СІ . Тобто, йде зруйнування кристалічної решітки і гідратовані іони виходять у розчинник, утворюючи однорідну систему – розчин. →
Схема розчинення кристалів NaCI Таким чином, розчинення кристалічної речовини можна уявити як подвійний процес: 1. Гідратація частинок (молекул, атомів, іонів). 2. Зруйнування кристалічної решітки. Як і кожний процес, процес розчинення проходить з виділенням або поглинанням енергії. Загальний тепловий ефект розчинення буде складатися із алгебраїчної суми енергії гідратації (+, завжди екзотермічна) і енергії кристалічної решітки завжди ендотермічна); теплота розчинення. тобто; Коли с, то , виділяється тепло, Коли с, то , поглинається тепло, Наприклад, розбавляємо Н Коли лити кислоту у воду, температура розчину буде С, а коли навпаки 180 С (небезпечно). Коли розчиняти – температура знижується до – С. Способи вираження концентрації розчинів. Концентрація – це кількість речовини розчиненої в якій-то визначеній кількості розчину або розчинника. Концентрації бувають: Масова частка (Процентна,відсоткова концентрація) Процентна концентрація показує скільки грамів речовини знаходиться в 100 г розчину. m
– маса розчиненої речовини, – маса розчинника; це 5г г Н О Молярна частка( Молярна концентрація) Молярна концентрація виражається числом молей розчиненої речовини в 1 л розчину. n
См V , де – число г моль розчиненої речовини. – n M , де – маса розчиненої речовини. М – її молярна маса.
Наприклад, треба приготувати 2 М розчин Мол. маса 98, а г моль = 98 г 2 М = 2 х 98 = 196 г. Таким чином треба відважити 196 г і вилити її у воду, потім довести до 1 л. Все це робиться у мірному посуді. Моляльність(Моляльна концентрація) Моляльна концентрація виражається числом г молей речовини розчиненої у 1000 г розчинника. С ; де – число г молей. Наприклад, треба приготувати 1 м Н РО Мол.маса = 98. г моль = 98 г. Для цього треба взяти 98 г кислоти і 1000 г води. Молярна концентрація еквівалентнів (Н ормальна або еквівалентна концентрація) Нормальна концентрація показує скільки г-екв розчиненої речовини знаходиться в 1 л розчину.
Э – вага розчиненої речовини. Э – еквівалент розчиненої речовини. обєм розчину. Наприклад, треба приготувати 1н розчин . М.в = 98 в.о. 1ГМ = 98 г. 1г екв = 98 : 2 = 49 г. Тобто, треба взяти 49 г кислоти вилити у воду і довести до 1 л. Це робиться у мірному посуді. Визначення еквівалентуА ( атомна вага) 1. Еквівалент будь якого елемента В (валентність) Молекулярна вага кислоти 2. Еквівалент кислоти основність Молекулярна вага основи 3. Еквівалент основи кислотність Молекулярна вага солі 4. Еквівалент солі = кількість атомів метала х на його валентність Молекулярна вага оксиду Еквівалент оксиду = кількість атомів елемента х на його валентність Титр – це кількість грамів розчиненої речовини в 1 см3 , або 1 мл розчину. N *Э
Т 1000 ; де Т – титр. нормальність розчиненої речовини. Э еквівалент „ Титр 0,1 н НСІ = 3,65 мг/мл. Концентрація титрованого розчину виражається числом грам – еквівалентів, які містяться в 1 л розчину (нормальні розчини) або числом молекул розчиненої речовини, яка міститься в 1 л розчину (молярні розчини). Формули перерахунку процентної концентрації в молярну або нормальну. Часто на практиці приходиться зустрічатися з розчинами концентрація яких не відповідає заданій. Тому, приводяться формули перерахунку концентрацій. ; де Эх масова доля розчиненої речовини, в %. маса) р щільність розчину, в г/см ; (р = (обєм) Мх молярна маса, в г/моль. См молярна концентрація , в моль/л нормальна концентрація г экв/л Эх еквівалентна масса (див. визначення еквіваленту). Виправлення концентрацій1. Коли розчин слабіший, ніж потрібно (а – в) , де с а а – необхідна концентрація. в концентрація Вашого розчину. с розчин або речовина, яку повині добавить. (Береться 100% розчин або суха речовина). Наприклад, із 45% розчину треба зробити 48%. – = 5,77 г на 100 мл 45% розчину. – а (с в) 2. Коли розчин міцніший, ніж потрібно , де в а кількість розчину. в потрібна концентрація. с концентрація Вашого розчину. Наприклад, із 23% розчину треба зробити 20%, 120 мл – = 18 мл, це треба добавити води. Правила змішування розчинівДля приготування розчинів потрібної концентрації, часто приходиться використовувати розчини другої концентрації. Для цього користуються „правилом змішування”, „діагоналі” або „хреста”. Наприклад, треба із 50% та 20% розчинів приготовить 30%. Концентрація одного розчину 50% необхідна конц. Концентрація другого розчину Дізнаємося відносну вагову кількість обох розчинів. Для цього від більшої концентрації віднімаємо потрібну (50 – 30 = 20 ), а потім від потрібної віднімаємо більш низьку (30 – результат другого віднімання результат першого віднімання усього 30% розчину Тобто, на 10 вагових частин 50% розчину треба взяти 20 частин 20% розчину. Користуючись правилом змішування, можна: змішувати розчини, концентрації яких виражені в процентах. розбавляти розчини заданої концентрації водою. змішувати розчини, концентрації яких виражені в щільності. розбавляти розчини заданої концентрації водою. збільшувати концентрацію розчину шляхом змішування останнього з твердою речовиною. При цьому треба ураховувати: коли концентрація розчину дається у вагових процентах, то відповідь одержують в вагових одиницях (г, кг, і т. д .). коли концентрації виражаються в щільності розчинів, то відповідь одержують в обємних одиницях (мл, л, і т. д.). Розчин з великою концентрацією розчиненої речовини називається концентрований або кріпкий (міцний) . З малою концентрацією – розведеним або слабим. Не треба змішувати поняття концентрований з насиченим. Концентрований не завжди може бути насиченим. Насичений розчин – це коли наступає рівновага між розчиненою речовиною і осадом. Коли речовина добре розчиняється у розчиннику, тоді розчин може бути концентрований але не насичений. Наприклад, 20% – цей розчин концентрований але не насичений. Для його насичення треба розчинити 31,5г в 100 г Н О. Насичений розчин може бути дуже розведений – це коли речовина погано розчиняється у розчиннику. Наприклад, гіпс 0,21 г в 100 г Н О. Цей розчин насичений але розведений. Розчинність твердих речовин, рідин та газівМірою розчинності, при даних умовах, є концентрація насиченого розчину Тому вона виражається тими самими величинами, що й концентрація. Розчинність коливається у широких межах. Коли в 100г Н О розчиняється 10г речовини, то така речовина називається легкорозчинна до 1г – трудно розчинна; менше 0,01 г – нерозчинна. Абсолютно нерозчинних речовин нема. Р о
підвищенням температури усі тверді речовини збільшують свою розчинність. Розчинність спочатку підвищується, а потім з витраченням Н О розчинність зменшується. Тиск практично не впливає на розчинність твердих речовин у рідинах, тому що об, єм системи із зміню тиску майже не змінюється. Рідини також можуть розчинятися в рідинах: спирт – вода, вода ацетон. Розчинність газів із підвищенням температури зменшується, а з підвищенням тиску – збільшується. Тому щоб позбавитися неприємного запаху у воді її треба прокип‟ятити. Залежність розчинності газу від тиску виражається правилом Генрі Розчинність газу прямо пропорційна його парціальному тиску (t0 -const). Парціальний тиск – тиск компонента ідеального газової суміші, який він дав би один займаючи об‘єм усієї суміші). Тобто, коли збільшити тиск у 2 рази розчинність газу також зростає в 2 рази. Як дослідив Дальтон (1807 р.) У випадку суміші газів, кожний із них розчинюється пропорційно своєму парціальному тиску і розчинності. Розчинність газів, які вступають у взаємодію з водою різко підвищується. СО НСІ, НВ ..... Тому розчинність їх не підлягає закону Генрі і Дальтона. Лекція 7. Розчини неелектролітів (продовження)План Осмос. .Закон Вант–Гоффа. Тиск насиченого пара. .1. Закон Рауля (1). .2. Кріоскопія та ебуліоскопія. .3. Закон Рауля (ІІ–ІІІ). 4. Антифризи. Осмос. Осмотичний тискРозчинена речовина прагне до того, щоб рівномірно розподілитися по всьому об„єму розчину. Це відбувається шляхом дифузії – взаємного проникнення молекул розчиненої речовини і розчинника один в одному. Якщо взяти розчин цукру і воду, розділити їх напів проникною перегородкою з порами, крізь яку проходить тільки вода, ми помітимо, що об„єм розчину цукру збільшиться. Така однобічна дифузія крізь напівпроникну перегородку називається осмосом. Тиск, що чине розчин на стінки посудини в результаті дифузії називається осмотичним тиском.
дифузія осмос Осмотичний тиск пропорційний молярній концентрації розчиненої речовини і абсолютній температурі. = С , де С молярна концентрація, універсальна газова постійна (8, 314 Дж/ К моль), Т – абсолютна температура (273о К). Знайшовши аналогію між газами і розчинами Вант Гофф сформулював слідуючий закон: Осмотичний тиск дорівнює тому тиску, який чинила б розчинена речовина, перебуваючи в газоподібному стані і займала об„єм , рівний об„єму розчину. По теорії Вант Гоффа процес розчинення уподібнюється випарюванню. В обох випадках розчинена речовина розповсюджується по усьому об„єму. Тиск газу – це результат ударів молекул. Осмотичний тиск – це результат збільшення об‟єму розчину в результаті дифузії. Закон Вант–Гоффа дійсний тільки для розбавлених розчинів. Осмотичний тиск має велике значення в біологічних процесах: усмоктування, виділення вологи, утамування спраги і т. д. Осмотичний тиск створює тургорне становище в рослинних тканинах, тому гриби можуть рвати асфальт. Тиск насиченого параРідина, знаходячись у відкритому посуді випаровується повністю. У закритому – між рідиною і паром установлюється рухома рівновага при якій в одиницю часу скільки молекул випаровується, стільки їх і утворюється. Пар, який знаходиться у рівновазі з рідиною називається насиченим, а тиск з яким він діє на стінки посуду називається тиском насиченого пару. Тиск насиченого пару із збільшенням температури – зростає. Поверхня розчину складається із молекул розчинника і розчиненої речовини. Це значить, що в одиниці часу випаровується менше молекул чим з чистого розчинника. А тому розчинена речовина знижує тиск пара розчинника, так як вона займає частину площі випаровування. На основі цього франц. фізик Рауль у 1887 р. установив слідуючий закон: У розведених розчинах неелектролітів зниження тиску насиченого пара пропорційно кількості речовини розчиненої в даній масі розчинника або: Пониження тиску насиченого пара над розчином пропорційно молярній концентрації розчиненої речовини. (Перший закон Рауля). Коли позначити тиск пара над чистим розчинником через Р, а тиск пара над розчином Р , то (Р – Р – буде зниження тиску пара (∆ Р). – число молей розчиненої речовини неелектроліту. – число молей розчинника, то
Із закону видно, що зниження тиску пара не залежить від природи розчиненої речовини, а залежить від кількості молекул цієї речовини. Температура замерзання (кріоскопія) і температура кипіння (ебуліоскопія) розчинів. Тиск пара над чистим розчинником завжди більший, ніж над розчином. Внаслідок цього, щоб тиск пара досяг зовнішнього (атмосферного) тиску, розчин треба нагрівати до більшої температури ніж чистий розчинник. Тому температура кипіння розчинів завжди більша, ніж температура кипіння чистого розчинника. Також наслідком зменшення тиску пара над розчином є зменшення його температури замерзання порівняно з температурою замерзання чистого розчинника. Треба звернути увагу, що вищезазначені зміни температур замерзання та кипіння розчинів не залежать від природи розчиненої речовини, а визначаються тільки кількістю частинок (молекул або частинок іншої природи) розчиненої речовини, що міститься в однаковій масі розчинника. Усі чисті речовини характеризуються строго визначеними константами замерзання і кипіння. Вода 0 С – замерзає; 100 С – кипить Бензол 5,5 С – – С – – Інакші обставини з розчинами. Присутність розчиненої речовини підвищує точку кипіння і знижує точку замерзання. Як видно з рисунка, тиск пара над водою більший, чим над розчином. Тому, щоб тиск був однаковий треба розчин підігріти вище 100 С.
Щоб рідина замерзла, треба щоб тиск насиченого пара був рівний тиску, коли вона перебуває у кристалічному стані. Рауль установив, що: Пониження температури замерзання і підвищення температури кипіння пропорціональні моляльній концентрації розчиненої речовини. (Другий і третій закони Рауля). Математично залежність зміни температури замерзання та температури кипіння від концентрації розчину записується у вигляді рівнянь: Δ зам = Ккр · С Δ кип = Ке · С де Ккр – кріоскопічна константа від грецького слова “ ” – холод Ке ебуліоскопічна константа від латинського слова – викіпати С – моляльна концентрація розчину, що показує на кількість розчиненої речовини у 1000 г розчинника; одиниця розміру [моль/кг]. Якщо маємо “m” грамів речовини, що розчинені в “L” грамах розчинника, то моляльна концентрація має вигляд:
C = (3) M L Підставимо (3) у рівняння (1) і (2) маємо:
Δ кипде М – мол кулярна маса розчиненої речовини. Коли концентрація розчиненої речовини 1 моляльна (1 моля в 1000 г розчинника то: Δ зам КкрΔ кип Ке (7) , тобто Ккр кріоскопічна константа показує на скільки градусів знижується температура замерзання одномоляльного розчину порівняно з температурою замерзання чистого розчинника; вона залежить тільки від природи розчинника: для води Ккр = 1,86: для бензолу Ккр = 5,1; для оцтової кислоти Ккр Ке ебуліоскопічна константа показує на скільки градусів вище кипить одномоляльний розчин неелектроліту порівняно з чистим розчинником; вона залежить тільки від природи розчинника: для води Ке = 0,52 ; для бензолу Ке = 5,5; для оцтової кислоти Ке
З вищеозначенного можна зробити висновок, що зниження температури замерзання одномоляльних водних розчинів неелектролітів, які містять 6,02*10 молекул (1 моль, число Авогадро) вуглеводу сахарози, фруктози або глюкози дорівнює – , тому що кріоскопічна константа води дорівнює Тобто: усі речовини (неелектроліти), які мають 1 моляльну концентрацію розчину будуть кипіти і замерзати при одній і тій же температурі (вони мають однакове число молекул 6 – число Авогадро. Глюкоза, гліцерин, сечовина ....). Аналогічно водні одномоляльні розчини неелектролітів киплять при температурі на вище, ніж чиста вода, тобто при температурі 100,52 С (за умовою нормального атмосферного тиску, що дорівнює 760 мм рт.ст. або 101,325 кПа). Тобто: усі речовини (електроліти), які мають 1 моляльну концентрацію будуть кипіти і замерзати при різних температурах. (Див. Ступінь дисоціації) З рівнянь (4) і (5), знаючи Δtзам або Δtкип , можна підрахувати молярні маси розчинених неелектролітів. Відповідно до процесів розпізнають кріоскопічний або ебуліоскопічний метод визначення молярних мас речовин. Кріоскопічний метод є особливо цінним для речовин, які не можна перетворити у газоподібний стан (білки, цукор, глюкоза, фруктоза тощо). Молярна маса розчиненої речовини підраховується по формулі
М t ЗАМ L Для розрахунку замерзання або кипіння антифризів користуються формулами
Δtзам – пониження температури замерзання розчинів; Δ кип підвищення температури кипіння розчинів; Ккр кріоскопічна константа; Ке ебуліоскопічна константа; – маса неелектроліту; М – молекулярна маса неелектроліту; – маса розчинника. Антифризи – рідини (розчини) з низькими температурами замерзання. Вони застосовуються в системі охолодження автомобілів та тракторів. Найбільш поширеними є антифризи на основі етиленгліколю (С Н (ОН) – двоатомний спирт). На практиці поширені дві марки антифризів на основі етиленгліколю з температурами замерзання – С (марка „40”); С (марка „ ” Знаючи, формули розрахунку температури замерзання (кристалізації) або кипіння, давайте приготовимо антифриз із етиленгліколю (С Н (ОН) ), який замерзав би при температурі о С, знаючи, що води усього 5 л. зам * М
Значить, на 5 л води треба взяти 3, 333 кг етиленгліколю. А тепер давайте розрахуємо при якій температурі буде кипіти цей же розчин о кипЗначить, антифриз буде кипіти при 100о о о Що характерно, зам етиленгліколю (С Н (ОН) С, а якщо його розбавляти водою у відношені 70 : 30, можна приготувати антифриз, який буде замерзати при мінус о С. С Н (ОН) Н О зам – – –Таким чином, готують антифризи не тільки з етиленгліколю, а ще й з гліцерину (С Н (ОН) ) та других речовин. Лекція 8. Розчини електролітівПлан. 1.Що таке електроліти і неелектроліти. 2.Що називається електролітичною дисоціацією. 3. Дисоціація кислот, лугів і солей. 4. Ступінь дисоціації, 5. Фактори які впливають на дисоціацію. Константа дисоціації. Дисоціація води. Гідроліз солей. Усі речовини розділяються на електроліти і неелектроліти. Електроліти – це ті речовини, які у розплавленому або в розчиненому стані проводять електричний струм. Неелектроліти – речовини, які у розплавленому або у розчиненому стані не проводять електричний струм. До електролітів відносяться солі, кислоти, основи. До неелектролітів – органічні сполуки: спирти, ефіри, кетони, вуглеводи, масла. Як ми бачимо до електролітів відносяться речовини, в молекулах яких атоми зв‟язані сильно полярними або іонними зв‟язками. Багато речовин ще в твердому стані мають іонну структуру: а , КОН, Н РО , але у такому стані у них іони міцно зв‟язані один з одним, так як мають протилежно заряджені частинки (катіони + і аніони ) і тому їх рух затрудняється (стає неможливим). Коли тверду речовину перевести у розплав або розчин іони отримують волю і починають рухатися. Коли через такий розчин пропустити постійний струм то позитивно заряджені частинки направляються до катоду і називаються а негативно заряджені направляються до аноду і називаються. аніонами - . → Процес розпаду електроліту на іони під дією полярних молекул розчинника називається електролітичною дисоціацією. У хімії розпізнають сильні і слабі електроліти. До сильних відносяться: Усі солі, за винятком деяких комплексних солей. Гідроокиси лужних і лужноземельних металів. Неорганічні кислоти (Н – І ступінь.) До слабких відносяться: 1.Органічні кислоти (оцтова, винна, щавлева), а також неорганічні: Н ....і др. . Усі гідроокиси металів, крім вище названих. 3. Гідроокис амонію. Розглянемо дисоціацію сильних електролітів. Дисоціація кислотПри розчинені у воді кислоти дисоціюють на позитивно і негативно заряджені іони. НСІ → Н + СІ Як бачимо одноосновні кислоти дисоціюють в одну стадію, а багатоосновні – ступінчато, по ступеням, наприклад: → Н → Це відбувається тому, що в їх розчинах установлюються складні рівноваги, у яких беруть участь іони різноманітного вигляду. Із точки зору електролітичної дисоціації кислотами називається – електроліти які у водних розчинах дисоціюють тільки на катіони водню і аніони кислотного залишку. Потрібно говорити слово тільки тому, що гідросолі також дисоціюють на аніони водню і на катіони металу. → – Словом тільки ми виключаємо катіон Дисоціація основОснови у водних розчинах також будуть дисоціювати. Наприклад, → –Як бачимо, одно кислотні основи, дисоціюють в одну стадію, а багато кислотні основи як і кислоти дисоціюють ступінчато. → – → –Основами називається – електроліти які у водних розчинах дисоціюють тільки на аніони гідроксильної групи (ОН– ) і катіони металу. Слово тільки виключає другі аніони як, наприклад, із гідроксосолей. → – – У цьому випадку – Крім типових кислот і основ є гідроксиди, які проявляють амфотерні властивості. Наприклад, ↔ ↔ ↔ – – –↔ ↔ ↔ У цьому разі в залежності від середовища вони можуть вести себе як кислоти або як основи (хамелеони). Наприклад, гідроксид цинку може реагувати з кислотами, в цьому випадку він веде себе як основа: → Але реагуючи з лугами – виступає у ролі кислоти: Н → Дисоціація солейУсі солі належать до сильних електролітів, тому дисоціюють на такі іони: → → → Солями називаються електроліти, які у водних розчинах дисоціюють на катіони металу і аніони кислотного залишку. Кількісно процес дисоціації можна охарактеризувати декількома величинами: ступінню електролітичної дисоціації, константою або еквівалентною електропровідністю. Процес дисоціації – зворотний процес, який називається. молекуляризацією Тому можемо зазначити, що не всі молекули розпадаються на іони. Таким чином можна сказати, що в одиниці об‟єму розчину електроліту число частинок (молекул і іонів) буде більше чим у такому ж об‟ємі неелектроліту. То, звичайно і другі величини як: осмотичний тиск, збільшення точки кипіння, зниження точки замерзання і др. будуть для електролітів більші чим для неелектролітів. Тому ввели поправочний коефіцієнт ί, який називається ізотонічним, або коефіцієнтом Вант–Гоффа. Тобто, це відношення результату фактично полученого до теоретичного.
Ізотонічний коефіцієнт для розчину неелектроліту буде рівний нулю (ί = 0). Для водних розчинів електроліту з такими ж моляльними концентраціями ί > 1. Це відбувається тому, що кількість частинок у такому розчині більше, ніж у неелектроліту, бо електроліт при розчинені розпадається на іони. Для асоційованих молекул (спирту, бензолу...), ί < 1. Ізотонічний коефіцієнт показує, у скільки разів збільшується число частинок у розчинах електролітів внаслідок їх дисоціації на іони. Так, для коефіцієнт дорівнює двом; для К трьом і т. д. Тому для кількісної характеристики процесу дисоціації було введено поняття ступінь дисоціації. Ступінь електролітичної дисоціації указує, яка частка молекул розчиненої речовини знаходиться у розчині у врівноваженому (асоційованому) стані. Вона дорівнює: Відношенню числа молекул, які розпалися на іони, до загального числа молекул розчиненої речовини, тобто:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н | ОН |
![]() 55,56моль
/ л
55,56моль
/ л
![]()
![]() 1,8*1016
55,56
1,8*1016
55,56
Звідси ![]() г іон/л
г іон/л
Для води добуток концентрації водневих іонів на гідроксильні є постійною величиною, яка називається іонним добутком води.
К
Н
2О
![]()
Коли концентрація водневих іонів рівняється концентрації гідроксильних іонів розчин буде нейтральний:
нейтральні
кислі основні
Для кількісної характеристики середовища більш зручно користуватися водневим показником (рН), який рівняється негативному логарифму концентрації водневих іонів.
– , тоді нейтральне середовище = 7, кисле , основне > 7.
![]()
сильно слабо нейтральна слабо сильно кисла кисла основна основна
Характеристика середовища по і рН дає зробити слідуючи висновки:
1. Чим вище концентрація водневих іонів, тим менша рН і більша рОН.
2. Чим вища концентрація гідроксильних іонів, тим більша величина рН і менша рОН.
3. При підвищенні концентрації водневих іонів у 10 разів рН зменшується на одиницю і навпаки.
Для точного вимірювання рН користуються приборами – рН метрами або іономерами. Для приблизного – індикаторами (фенолфталеїн, лакмус, універсальна папір і т.д.).
Іонні реакції обміну
Згідно теорії електролітичної дисоціації хімічні реакції проходять між іонами і вони доходять до кінця в трьох випадках: коли утворюється малодісоційована речовина, газоподібна або осад.
Зворотні реакції
↔
В іонному вигляді
↔
У цьому разі у розчині знаходяться 4 іона: . Якщо випарити цей розчин, то отримаємо суміш 4 х солей, тобто між цими солями реакція не відбувається.
Виявляється, що реакція між іонами проходить до кінця, коли утворюються малодисоційовані, газоподібні речовини або осад.
→
→
→
Реакція відбудеться, бо утворюється малодісоційована речовина вода.
→
→ ↑
→ ↑
Реакція відбудеться, бо утворюється газообразна речовина.
→
→ ↓
→ ↓
Реакція відбувається, бо утворюються осад.
Добуток розчинності
Проходить реакція, при якій утворюється осад.
→ ↓
Осад находиться у рівновазі з насиченим розчином
↔ –
Ва 2 SO 42
![]() К
дис
BaSO
4
; концентрація ↓ величина постійна, тоді:
К
дис
BaSO
4
; концентрація ↓ величина постійна, тоді:
![]() К
дис
Ва
2 SO
42
К
дис
Ва
2 SO
42
Добуток розчинності – це добуток концентрацій іонів малорозчинного електроліту, який знаходиться у насиченому розчині. Добуток розчинності постійна величина. (Приводиться в таблицях).
Гідроліз солей
Гідролізом називається хімічна взаємодія іонів розчиненої солі з іонами Н + і ОН- води, в результаті якої утворюються газоподібні, малодисоційовані або важко розчинні речовини і змінюється рН середовища.
Розглянемо декілька випадків гідролізу.
1. Гідроліз солі, що утворена сильною основою і слабою кислотою.
→
→
→ ↑
→ ↑
У цьому разі йде накопичення ОН . Середовище лужне. рН
2. Гідроліз солі, що утворені сильною кислотою і слабою основою.
→
→
→
Йде збільшення [ +]. Середовище кисле. рН
3. Гідроліз солі, що утворена слабою кислотою і слабою основою.
→
↑
→ ↑
У цьому випадку утворюються малодисоційовані і Гідроліз проходить рН ≈
4. Гідроліз солі, що утворена сильною кислотою і сильною лугом.
+ НСІ →
→
→
Гідроліз солі не йде, бо не змінюється рН середовища.
Примітка: багатоосновні кислоти і багатокислотні основи гідролізуються ступінчато. Дивіться лецію «Електлітична дисоціація».
Ступінь гідролізу солі.
Ступінь гідролізу – це відношення числа гідролізованних молей солі до загальної
кількості молей солі в розчині..
Ступінь гідролізу визначається відношенням:
числа молей солі, які піддалися гідролізу
β загальне число молей солі в розчині
Ступінь гідролізу залежить від природи розчиненої солі. Чим слабкіші основа і кислота, які утворили сіль, тим вищий ступінь гідролізу.
При підвищені температури ступінь гідролізу зростає.
Від розбавлення водою, ступінь гідролізу збільшується до нескінченності.
При підвищенні концентрації одного із продуктів гідролізу, ступінь гідролізу зменшується.
План
Класифікація хімічних реакцій.
Значення окисно – відновних реакцій.
Поняття про ступінь окислення.
Окислювальне число.
Валентність елемента.
Положення окислювачів і відновників в періодичній системі Д.І. Мендєлєєва.
Головні окислювачі і відновлювані.
Методи складання окисно – відновних рівнянь.
Метод електронного балансу.
Іонно електронний метод.
Окисно відновні реакції особистого типу.
Існують багато різних видів хімічних реакцій: Сполучення. Наприклад,
2Н + О → 2Н О
→
Розкладання. Наприклад,
СаСО →
→ О
Заміщення. Наприклад,
→ →
Обміну. Наприклад,
→
→
Заслуговують особливої уваги окисно – відновні реакції. На відміну від реакцій обміну вони супроводжуються переходом електронів від одного атома до другого. В звязку з цим :
окисно – відновними реакціями називається такі реакції, які відбуваються за рахунок переходу електронів від одних атомів або іонів до других. (Тобто, йде віддача та приєднання електронів).
Окисно – відновні реакції належать до найбільш розповсюджених і мають велике значення. Наприклад, без них не було б реакцій горіння, добування металів із руд, наш організм не поповнювався киснем, рослини не синтезували б білки, жири, вуглеводи і другі органічні сполуки і т. д.
Історично першим появилось поняття „відновлення”, під яким розуміли – відомості одержання металів із окалини.
З відкриттям кисню (ХУ111 в) ввели поняття „окислення”, кисневу теорію Лавуазьє, за якою „відновлення” стали називати отримання металів і неметалів із оксидів.
→
→
Окисленням стали називати приєднання кисню до елементу, або сполуки з утворенням оксиду.
→
→
Але більшість окисно – відновних реакцій проходили без участі кисню, наприклад
→
→
Через це з розвитком учення про будову атома, киснева теорія була замінена на більш досконалу – електронну теорію. З цією теорією вперше виступили російські учені Пісаржевський, Шилов, Кістяківський.
Згідно електронної теорії при окисно – відновних процесах йде перехід електронів від одного атома або іона до другого, наприклад
→ →
→
В цьому випадку відбувся перехід електронів від срібла до хлору.
Речовини, які віддають електрони називаються відновниками, а процес віддачі електронів називається – окисленням.
Речовини, які приймають електрони називаються окислювачами, а сам процес - відновленням.
Отже, в процесі реакції окислювачі відновлюються, а відновники окислюються.
При хімічних реакціях йде тільки перерозподіл електронної щільності, яка приводить до утворення нових хімічних сполук. Тому, в даний час, при розглядані цих процесів, користуються поняттям „ступінь окислення” або „окислювальним числом”, яке треба відрізняти від валентності.
Валентність - це властивість атома одного елемента приєднувати до себе один або декілька атомів других елементів, або – це число, яке показує на кількість зв,, язку одного елемента з другим при утворені сполуки.
Валентність не має заряду + чи , наприклад
→
Валентність водню і хлору до і після реакції рівні 1.
Н – Н ; – –
Ступінь окислення (дивіться далі) водню і хлору до реакції рівняються нулю, а після реакції: водню + 1, а хлору 1, тобто:
о о
→
Характерно те, що валентність завжди буває цілим числом, а ступінь окислення може бути як цілим, так і дробовим числом, наприклад у пропану ступінь окислення вуглецю
8/3, а валентність 4.
Що таке ступінь окислення?
Ступінь окислення чисельно рівне заряду, який виникнув би на атомі даного елемента, коли б валетні електрони повністю перейшли до більш негативного атома.
Ступінь окислення показує на стан елемента в сполуках і характеризується окислювальним числом. Окислювальне число може бути позитивне, негативне і рівне нулю. Позитивне – коли елемент віддає електрони;
→
→
Негативне – коли елемент приймає електрони;
→
→
Рівне нулю – коли не віддає і не приймає
Сао , Со …
Окислювальне число визначається по числу відданих, або прийнятих електронів і позначається
і
При визначені ступеня окислення треба пам, ятати:
Ступінь окислення елементів в вигляді простих речовин – рівна нулю. о о
…
Ступінь окислення водню у всіх сполуках, крім гідридів, рівна плюс одиниці (+1):
…., в гідридах мінус одиниці ( 1). (Гідриди – це сполуки металів з
воднем:
Ступінь окислення кисню у всіх сполуках, крім перекисів, рівна мінус два (
…, в перекисах мінус одиниця ( …
Алгебраїчна сума ступені окислення сполук – рівна нулю. Наприклад, в сірчаній кислоті сума позитивних зарядів (+8) рівна сумі негативних –
Ступінь окислення, як і валентність для даного елемента - величини перемінні. Наприклад у ступінь окислення і валентність вуглецю і кисню рівна 2. У ступінь окислення і валентність вуглецю змінюється на 4, а ступінь окислення і валентність кисню остається такою же (2).
Розглянемо в якому стані і які атоми можуть бути окислювачими і відновниками.
Окислювачами можуть бути:
Нейтральні атоми неметалів.
→
→
Позитивні іони неметалів на нижчий, проміжній і вищій позитивній ступені окислення.
→
→
→
→
3. Іони металів на нижчий і вищій позитивній ступені окислення.
→
→
→
→
4. Іони металів і неметалів на вищій ступені окислення бувають тільки окислювачами.
→
→
Відновниками можуть бути:
Електронейтральні атоми металів і неметалів.
→
→ →
→
Негативні іони неметалів.
→
→
Іони металів і неметалів на нижчий і проміжній ступені окислення.
→
→
→
→
Ступень окислення елемента в сполуках залежить від:
Сили окислювача і відновника.
Кислотності і температури.
Концентрації окислювача і відновника.
→
→
Правила складання окисно – відновних рівнянь
Скласти рівняння реакції – це визначити кінцеві продукти реакції і знайти коефіцієнти.
Існує два методи складання окисно – відновних рівнянь.
Метод електронного балансу. Іонно – електронний метод. Метод електронного балансу заключається ось в чому:
Записуємо рівняння реакції в молекулярному вигляді.
→
Визначаємо ступені окислення кожного елемента в рівнянні реакції (див. визначення ступені окислення).
С →
Знаходимо які елементи поміняли ступінь окислення.
→
→
4.Складаємо електронні рівняння, які виражають процеси окислення і відновлення.
→
→
По правилу найменшого кратного визначаємо коефіцієнти для окислювача і відновника.
→ коефіцієнт
найменше кратне
→ коефіцієнт
Ці коефіцієнти підставляємо в рівняння реакції.
→
Ті елементи, які не приймали участь в реакції, урівнюємо звичайним методом.
→
Іонно – електронний метод (метод полуреакцій)
Слід памятати, що цей метод приміняється тільки для розчинів електролітів.
При складанні рівнянь окисно – відновних реакцій методом електронного балансу приходиться зустрічатися з деякими труднощами у визначенні ступені окислення, а так же мати справи з різними не існуючими іонами. Усіх цих неточностей можна уникнути при іонно – електронному методі.
При цьому методі не треба знати ступінь окислення елементів, так як їх знаходять простим способом, підраховуючи загальну суму зарядів у правій і лівій частинах.
Также треба пам ятати, що коли Н О виступає в ролі окислювача, вона розкладається на: Н О +2е , а як відновник на:
Не треба знати продукти реакції, вони появляються в рівнянні при написанні остаточного молекулярного рівняння.
В цьому методі приміняються не гіпотетичні (здогадні) іони, а реально існуючі.
Наприклад, ….
Щоб скласти рівняння цим методом треба знати:
Записуємо формули усіх взятих і утворених іонів, атомів та молекул.
Урівнюємо число не кисневих атомів, які приймали участь в реакції.
Переносимо атоми, або групи атомів, які не брали участь в реакції у відповідну сторону без зміни (Н або ОН
Урівнюємо кисневі атоми:
У кислому середовищі на кожний лишній атом кисню дописуємо 2Н+ в ту сторону, де він лишній, а в протилежну – переносимо відповідну кількість молекул води (Н О).
4.2. У лужному середовищі – на кожний лишній атом кисню дописуємо молекулу Н О, а в протилежну сторону переносимо подвійну кількість гідроксильних груп (2ОН 5. Урівнюємо кількість зарядів в лівій і правій частинах обох рівнянь.
6. Урівнюємо кількість відданих і прийнятих електронів.
7. Записуємо сумарне рівняння в іонному і молекулярному вигляді, дописуючи необхідні катіони і аніони, які не приймали участь в реакції.
Розглянемо реакцію, яка проходить в кислому середовищу
Наприклад, при дії Н О в Н О осад марганцевистої кислоти розчиняється.
→
→
два іони водню (2Н+), які не брали участь в реакції, без змін переносимо в протилежну сторону.
→
→
Атоми кисню урівнюємо, добавляючи 2Н на кожний лишній атом кисню, де він лишній, а в протилежну сторону переносимо відповідну кількість молекул води (Н О).
→
→
Урівнюємо кількість зарядів (електронів) у правій і лівій частинах.
→
→
→
Скорочуючи загальні іони, записуємо реакцію в іонному і молекулярному виді.
→
→
А тепер розглянемо реакцію, яка проходить в лужному середовищі
Наприклад, до білого осаду гідроксиду вісмуту Ві(ОН) добавляємо лужного розчину станіту натрію ( ), при цьому утворюється чорний осад вісмута, так як пройшло відновлення вісмуту.
Записуємо вхідні речовини і продукти реакції:
→
→
Як бачите іони ОН , які не приймали участь в реакції переносимо без зміни в праву частину.
В другому рівнянні урівнюємо кисневі атоми: в лужному середовищі на кожний лишній атом кисню, в ту сторону де він лишній, дописуємо молекулу Н О, а в протилежну 2 ОН
→
→
Тепер урівнюємо кількість зарядів (електронів) відданих і прийнятих іонами.
→
→
Множимо ці два рівняння на відповідні числа(див. вище) і записуємо сумарні рівняння.
→
Скорочуючи одинакові іони, записуємо рівняння в іонному і молекулярному вигляді.
→
В молекулярному вигляді:
→
Класифікація окисно – відновних реакцій.
Окисно – відновні реакції можуть бути:
Міжмолекулярні - між молекулами.
→
→ коефіцієнт
найменше кратне
→ коефіцієнт.
2. Внутрімолекулярні.
О →
→ коефіцієнт
найменше кратне
→ коефіцієнт
Самоокислення - самовідновлення.
→
→ коефіцієнт
найменше кратне
→ коефіцієнт
Знаючи окисно – відновні реакції можна сміло приступати до вивчення електрохімії.
Електрохімія Лекція 10. Гальванічні елементи
План.
1. Основні положення електрохімії.
2. Поняття про електродні потенціали. Виникнення стрибка потенціалу.
3. Визначення і вимірювання електродних потенціалів.
4. Ряд напруги металів.
4. Гальванічні елементи.
5. Паливні елементи.
6. Атомні батареї.
7. Сонячні батареї.
Основні положення електрохімії
Хімічні процеси, що супроводжуються виникненням електричного струму або самі викликаються ним називаються електрохімічними.
Розділ хімії, що вивчає ці процеси називається електрохімією.
Електрохімічні реакції мають слідуючи особливості:
1. Вони відносяться до окисно відновних.
2. Протікають на межі електрод електроліт.
3. Спостерігається перетворення хімічної енергії в електричну.А тепер дайте відповідь на 2 запитання.
1. Зарядиться чи ні метал, що опущений в склянку з водою?
2. Зарядиться чи ні метал, що поміщений у вакуум?
І в першому і в другому випадку зарядиться. Розберемо більш докладніше
Кристалічна решітка складається із іонів металу і електронів, які вільно переміщуються в ньому.
Так, як абсолютно нерозчинних речовин нема, то і метали будуть розчинятися.
![]()
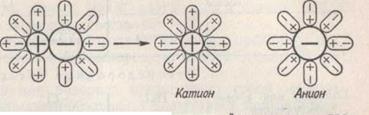
Уявіть собі, що ви опускаєте натрій у склянку з водою. Він почне розчинятися, посилаючи іони у воду. Вода від цих іонів метала зарядиться позитивно +, а електрони, які залишилися у металі зарядять його негативно.
Таким чином будь – який метал опущений у воду зарядиться негативно.
У вакуумі електрони, які вільно переміщаються по металу почнуть виходити у вакуум, заряджаючи його негативно., а іони метала, які залишилися зарядять метал позитивно. Таким чином, будь який метал у вакуумі, завжди зарядиться позитивно.
Поняття про електродні потенціали. Виникнення стрибка потенціалу.
Давайте розберемо 3 випадки.
![]()
ZnSO4 |
2 | ZnSO4 |
Н2 О |
1 3
1. У стакан з водою опускаємо цинкову пластинку .
Так як абсолютно нерозчинних речовин немає цинк почне розчинятися, посилаючи свої іони у воду. Вода від цих іонів зарядиться позитивно, а залишок електронів зарядить пластину негативно.
Таким чином на межі метал – розчин утворюється подвійний електродний шар або різниця потенціалів, яка називається електродним потенціалом . Так як, частіше усього, електродами в промисловості бувають вугільні, то
Електродний потенціал – це різниця потенціалів між електродом і електролітом.
2. У стакан з розчином ZnSO4 опускаємо цинкову пластинку, де концентрація іонів цинку ( ) така, яку цинкова пластина дає при розчиненні. Наприклад, 5 іонів.
Як усякий метал цинк почне розчинятися. Іони з металу виходять у розчин і в ту саму мить іони з розчину осідають на пластину. Наступає динамічна рівновага між іонами . Одні з пластини переходять у розчин, другі – із розчину осідають на метал. В результаті утворюється подвійний електродний шар або різність потенціалів, яка дорівнює = 0, тобто пластинка не заряджується.
Такий потенціал, який утворюється при рівновазі іонів, називається рівноважним потенціалом.
3. У стакан з насиченим розчином ZnSO4 опускаємо цинкову пластину, де концентрація іонів дуже велика. В цьому випадку йде не тільки подавлення розчинення металу, а іони із розчину будуть осідати на пластинку, заряджуючи її позитивно (+). А кислотний залишок
) зарядить розчин негативно (
Таким чином, у першому випадку метал зарядили негативно ( ), у другому – не зарядили, у третьому – зарядили позитивно (+).
Виявляється, змінюючи концентрацію розчину можна зарядити метал по різному
Розбавляючи розчин водою (3 стакан), можна поміняти полярність металу + ,через 0, на
Добавляючи насичений розчин солі у стакан, також поміняється полярність – , через 0, на +.
Отже полярність металу залежить від концентрації розчину.
Електродний потенціал (абсолютний) виміряти неможливо по 2 причинам:
1. Від вольтметра один провідник можна підключити до електроду, а другий до розчину – ніяк, крім того він становиться електродом.
2. Ці два провідники мають опір, а тому показник вольтметру буде не вірний.
Визначення і вимірювання електродних потенціалів.
Ряд напруг металів
Так як виміряти абсолютне значення електродного потенціалу неможливо, його визначають по формулі Нернста.
0,059
![]() Е
0 Е
0 lgC
i
n
Е
0 Е
0 lgC
i
n
Ео - електродний потенціал.
Е0 – стандартний електродний потенціал. n – валентність металу.
Сі – концентрація розчину.
Вимірюють електродний потенціал відносно водневого електрода (так як і атомну вагу, відносно вуглецевої одиниці, бо немає таких терезів, щоб зважили атом).
Водневий електрод представляє собою платинову пластинку, що вкрита рихлою
(губчастою) платиною. Ця пластинка опущена у 2 н розчин , з активністю іонів водню = 1 г іон/л. Крізь розчин пропускають водень під тиском в 1 ат.
Платинова пластинка, поглинаючи водень, веде себе так ніби–то вона зроблена із водню.
Різність потенціалів між “водневою” пластинкою і Н умовно приймають за 0.
![]()
Схема приладу для вимірювання стандартного (нормального) потенціала.
Різність потенціалів між металом опущеним у розчин своєї солі з концентрацією іонів металу 1 г *іон/л і водневим електродом називається стандартним (нормальним) електродним потенціалом.
Таким чином були виміряні електродні потенціали усіх металів, які створили ряд напруг металів:
Цей ряд представляє кількісну характеристику хімічних властивостей металів.
1. Чим нижча алгебраїчна величина електродного потенціалу, тим кращим відновником він являється. Тим більша його хімічна активність і навпаки.
2. Більш активний метал витісняє із солей менш активний.
. Метали, які знаходяться в ряду активності до водню, витісняють його із кислот.
. Метали, які знаходяться після водню можуть реагувати з кислотами, але не витіснятимуть його .
. У гальванічних елементах анодом зветься більш активний метал, тобто стандартний електродний потенціал якого має меншу алгебраїчну величину, а катодом навпаки.
Гальванічні елементи
Гальванічними елементами називаються такі елементи, у яких енергія окисновідновних реакцій перетворюється в електричну.
Щоб з‟ясувати, яким чином у гальванічних елементах хімічна енергія перетворюється у електричну, необхідно знати, які процеси протікають на окремих електродах.
Розглянемо роботу мідно – цинкового гальванічного елементу.
У реакції, де цинкова пластина реагує з електрони від цинку переходять до іонів міді.
2ē →
+ 2ē →
Цей перехід відбувається на дуже малій відстані (частки мілімікрон). При цьому хімічна енергія перетворюється в теплову.
Коли цю реакцію провести так, щоб окисно відновні процеси протікали окремо, тобто в різному посуді, з єднаних полупроникаючою перегородкою, а електроди провідником, тоді виникає електричний струм.
Перший гальванічний елемент був створений у 1800 р. італ. фізиком Вольтом. Удосконалили цей прилад російські учені Даніель і Якобі (1838 р.).
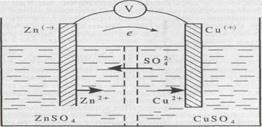
Схема мідно – цинкового гальванічного елемента.
Він складається із цинкової і мідної пластинок, занурених у розчин своїх солей: і . Розчини розділені один від одного пористою перегородкою із повсті.
У цинковому полуелементі , цинкова пластинка занурена у розчин своєї солі з концентрацією іонів цинку дуже малою. Цинк, як активний метал почне розчинятися, посилаючи свої іони у розчин. Розчин від цих іонів буде заряджатися позитивно, а залишок електронів зарядить пластину негативно. Цей процес швидко припиняється, бо позитивно заряджений розчин не буде пускати іони із металу, тобто буде їх відштовхувати на пластинку. Між ними встановлюється хімічна рівновага. Тобто, скільки іонів буде виходить із пластинки, стільки їх буде із розчину й осідати.
↔
У мідному полуелементі , мідна пластина опущена у розчин своєї солі, де концентрація іонів міді дуже висока. При цьому йде пригнічення розчинення пластинки і іони міді із розчину почнуть осідати на пластинку, заряджуючи її позитивно (+), а кислотний залишок зарядить розчин негативно ( ). Цей процес швидко припиняється тому, що пластинка зарядившись позитивно почне відштовхувати іони міді . Між ними встановиться рівновага.
+ 2 е ↔
Щоб елемент запрацював треба замкнути внутрішній і зовнішній ланцюги. Внутрішній ланцюг замикається безпосередньо іонами, які проникають крізь напівпроникну перегородку
Зовнішній ланцюг замикається металічним провідником. Електрони там, де їх
більшість (на цинковій пластині) по провіднику перейдуть туди, де їх не вистачає (на мідну пластинку).
Іони міді, які осідають на мідній пластині приймаючи ці електрони перетворюються у чисту мідь:
+ 2ē →
Таким чином у гальванічному елементі проходять ті самі реакції, що і у пробірці, але там енергія хімічної реакції перетворюється у теплову, а тут – у електричну. Це відбувається тому, що електрони рухаються на велику відстань.
Загальний процес, який відбувається в гальванічному елементі:
→
→
Як бачимо, електрони від цинкової пластини переходять до мідної.
Такий направлений рух електронів називається електричним струмом.
Але кожен повинен знати, що струм проходить у зворотному напрямі, тобто від мідної пластини до цинкової.
Умовний запис гальванічного елемента:
–
Електрорушійну силу (ЕРС) визначають: від електродного потенціалу окисника віднімають електродний потенціал відновника.
Е = Е –
ЕРС гальванічного елемента не залежить від розмірів електродів і кількості електроліту, а залежить від активності металу і концентрації електроліту.
Концентраційні елементи
У концентраційних елементах електроди та розчини однакові, але розчини у полуелементах мають різні концентрації.
![]()
Там де концентрація мала – цинк буде заряджатися , а де велика + , (хімічні процеси проходять так само, як у мідно – цинкового елемента).
Окисно – відновні елементи
У окисно відновних елементах електродами найчастіше є малоактивний метал або графітові стержні.
![]()
Розчини однакової концентрації, але різні, наприклад і
→
→
донор акц.
елект. елект.
окислення відновлення
Окисленими формами (ОФ) будуть:
і
Відновленими формами (ВФ) будуть:
і
Найбільшу спорідненість до електрону проявляє більш активний метал він і буде притягувати електрони від
2ē→ окислення
+ 2ē → відновлення
В результаті утворюються потік електронів від олова до заліза, а між електродами утворюється електродний потенціал, який називається окисно-відновним, або редоксіпотенціалом .
Електрод-окислювач це електрод, який приймає електрони із зовнішнього ланцюгу (акцептор) і є позитивним полюсом гальванічного елемента (
Електрод - відновлювач це електрод, який віддає електрони у зовнішній ланцюг (донор) і являється негативним полюсом гальванічного елемента (
ЕРС такого елемента буде: Е =
Крім елемента Даніеля – Якобі, трохи пізніше, з‟являються сухі елементи . Марганцево – цинковий абоЛекланше.
У якого негативним полюсом служить цинковий стаканчик, а позитивним – вугільний стержень, спресований у пакет із діоксида марганцю ( ) в суміші з графітом і сажею. Електролітом є паста із
4ē →
→
+ 4ē →
4ē
![]()
Газоподібний водень у цьому випадку не виділяється, що характерно для сухих елементів.
Окисно-ртутні елементи (мають меншу вагу і більший строк служіння)
/ 40% КОН /
Ртутно – індієві елементи – ще кращі, ніж окисно – ртутні.
40% КОН
У гальванічних елементах по мірі його роботи ЕРС буде зменшуватися. Це явище називається гальванічною поляризацією. Найчастіше поляризація спостерігається у позитивного електроду, де можуть розряджатися іони Н , утворюючи при цьому водневу подушку.
У меншій мірі підлягає поляризації негативний електрод, але концентрація іонів металу у розчині зростає, перехід нових іонів зменшується.
Усунення поляризації називається деполяризацією , а речовини які використовуються
для цього називають деполяризаторами. Це: О …
Ємність гальванічного елемента залежить від розмірів електродів і кількості електроліту і визначається:
, де
І – струм розрядки. час розрядки.
Паливні елементи
У паливних елементах електродами служать мілкопористі нікельові пластини.
Електролітом – – 40% КОН. Паливом – частіше Н , СО, природний газ , вугілля, спирт...
4е–
![]()
Електрони по зовнішньому ланцюгу переходять на катод:
![]()
О + 2Н О + 4е– 4ОН– катодне відновлення)
Гідроксильні іони у розчині рухаються від катода до анода:
2Н + О2Н О
Схема паливного елемента:
–
К К Д. (Коефіцієнт Корисної Дії) – теплових електростанцій 30
К.К.Д. паливних елементів
У всьому світі паливним елементам пророкують майбутнє. Що буде побачимо.
Атомні батареї
На поверхність напівпроводника (германія або кремнія) наносять шар радіоактивного стронцію – β – частинки вибивають із напівпровідника електрони, які рухаються в одному напрямку і накопичуються на колекторі.
На колекторі установлюється різність потенціалів 0,2 Строк дії 20 років. Стабільність напруги.
![]() Зєднуючи рамки між собою, можна одержати бажану напругу.
Зєднуючи рамки між собою, можна одержати бажану напругу.
Сонячні батареї
На поверхність напівпровідника кремнію наносять шар бора, який дуже чутливий до світла. Світло вибиває із напівпровідника електрони, які рухаються в одному напрямі і накопичуються на колекторі. Різність потенціалів 0 . З‟єднуючи рамки між собою можна одержати високу напругу.
Недолік : повинно бути завжди світло.
Лекція 11. Електроліз і його застосування
План.
1. Суть електролізу. Катодне відновлення і анодне окислення.
2. Послідовність розрядки іонів у електродів. Другорядні процеси при електролізі.
3. Електроліз з розчинним і нерозчинним анодом.
4. Закони Фарадея. Вихід по струму.
5. Потенціал розкладення. Перенапруження.
6. Явище поляризації.
7. Застосування електролізу.
Суть електролізу. Катодне відновлення та анодне окислення.
Електролізом називається окисно-відновний процес, що протікає на електродах при проходженні постійного електричного струму крізь розплав або розчин електроліту. При цьому йде перетворення електричної енергії у хімічну
Коли у розплав або розчин опустити електроди до яких підключений постійний електричний струм, до катоду мінус ( ) , а до аноду плюс (+) , то хаотичний рух іонів становиться упорядкованим. Позитивні починають переміщатися до негативного полюсу – катоду і тому називається катіонами, а негативні іони – до позитивного полюсу – аноду і називаються аніонами.
Суть електролізу заключається в тому, що на катоді йде відновлення, а на аноді – окислення. Тобто, що виділяється на катоді, а що на аноді.
При проведені електролізу користуються різними електродами. Електроди бувають нерозчинні – , вугільні. Усі інші розчинні. Розглянемо декілька випадків електролізу.
1. Електроліз розплаву NaCl
Схема гальванічної ванни.
→
+ 1ē →
2ē → ↑
На катоді йде процес відновлення катіонів натрію електронами зовнішнього джерела струму.
На аноді йде процес окислення аніонів хлору, при чому відрив електронів йде тим же самим джерелом струму.
В цьому випадку на катоді виділяється натрій, а на аноді хлор.
2. Електроліз водного розчину NaCl. При цьому бере участь вода.
→
Н О →
2Н О + 2ē → ↑
2ē → ↑
Так як потенціал води = 0,414в, то коли йде електроліз водного розчину солі, де потенціал металу менший потенціалу води, то відновлюється у такому разі не іони металу, а водню із води.
Таким чином на катоді виділяється H2 ↑ . На аноді Cl2 ↑ Як помітили, натрій і гідроксильна група (ОН, ) не виділяються.
Натрій у вигляді іонів ( ) буде знаходитися у розчині, притягуючись до катода, де з іонами води (ОН) утворює лужне середовище. Тому його можна виявити індикатором фенолфталеїном.
Помічено, що метали, які знаходяться у ряду напруг до алюмінію включно, не виділяються із водних розчинів на електродах при електролізі, замість них йде електроліз води і виділяється водень
Вихід по струму таких металів дорівнює 0. 3. Електроліз водного розчину FeSO4 .
→
Н О →
+ 2ē →
2Н О 4ē → ↑
У цьому випадку залізо знаходиться у ряду напруг після алюмінію, тому почне відновлюватися на катоді, тобто виділятися. При цьому іони водню (Н ) будуть накопичуватися біля катоду.
До аноду підходять іони і Виявляється, що іони утримують електрони
міцніше, ніж ОН іони води. Тоді на аноді буде йти окислення води і виділятися ↑
Тому у цьому випадку на катоді буде виділятися залізо, а на аноді ↑. Катіони водню (Н ) і аніони ( ) , будуть знаходиться у розчину.
Помічено, що залишки безкисневих кислот (Cl- , I- , Br- , S-2 , СN- …) виділяються на електродах при електролізі з водних розчинів, а залишки кисневих кислот (SO4 2- , SO3 2- , NO3 - , PO4 3- …) не виділяються, замість них йде окислення води і виділяється O2 ↑.
А тепер давайте проведемо електроліз наступної солі і вияснемо, що буде виділятися на катоді та аноді.
4. Електроліз водного розчину СaSO4 .
Сa → Сa
Н О →
2Н О + 2ē → ↑
2Н О 4ē → ↑
У цьому випадку до катоду підходять іони Сa і . Так як кальцій находиться у ряду напруг до алюмінію, то він виділяться не буде. Замість нього виділиться водень із води.
До аноду підходять іони і . Кислотний залишок не виділиться, замість нього виділиться кисень із води.
Таким чином одержати Сa і неможливо. Одержимо і Разом ці гази називаються гримучий газ. Тому маленька іскра і може статися великий вибух. У розчині йде нагромадження іонів Сa
До цього ми розглядали процеси електролізу, які відбувалися при нерозчинних електродах.
Але в промисловості застосовують і розчині аноди.
5. Електроліз водного розчину CuSO4 з розчинним анодом.
С → С
Н О →
+ 2ē →
2ē →
→ другорядні процеси:
У цьому випадку у розчині будуть іони С
До катоду підходять іони С і Будуть виділятися мідь і цинк
На аноді розчиняється цинк, іони цинку виходять у розчин і підходячи до катоду відновлюються і осідають на ньому.
2ē →
Таким чином анод розчиняється і переходить на катод. На катоді відкладаються два
метали і
А тепер уявіть собі, що ви берете 2 вугільних електроди, до яких підключений постійний струм, опускаєте їх у розплав і ведете електроліз. Що буде виділятися на катоді і аноді?
→
+ 2ē →
ē→ ↑ ↑
Виявляється, що із розплаву завжди можна одержати метал, а кислотний залишок кисневмісних кислот не одержите
Закони Фарадея. Вихід по струму.
Зв‟язок між кількістю речовини, яка виділяється при електролізі і кількістю електрики, яка пройшла через електроліт виражаються законами Фарадея
1. Однакова кількість електричного струму виділяє на електродах еквівалентну кількість речовин.
Для виділення на електроді 1г.екв. будь–якої речовини необхідно затратити одну й ту ж кількість електрики – 96500К. (Число Фарадея). Наприклад, при електролізі розплава виділяється 22,98 г і 35,45 г , тобто, як вони реагували в еквівалентних кількостях, так і одержуються.
2. Маси речовин які виділяються на електродах при електролізі прямо пропорційні кількості електричного струму, що протікає через електроліт.
Закон Фарадея можна виразити рівнянням:
е
 *I *t
*I *t
F , де
е – маса 1г.екв; – число Фарадея; – сила струму; – час (сек..)
![]() У багатьох випадках на практиці осідає метала менше чим розраховано по формулі Фарадея. Тоді використовують формулу, по якій розраховують вихід по струму: m
1
m
1
*96500
У багатьох випадках на практиці осідає метала менше чим розраховано по формулі Фарадея. Тоді використовують формулу, по якій розраховують вихід по струму: m
1
m
1
*96500
 *100; де
m Э* I *t
*100; де
m Э* I *t
–маса метала факт. одержана; – маса метала розрахована по формулі Таким чином вихід по струму; металів із розчинів по ряду напруг:
До Al включно – 0; від Al до H2 у середньому 50%; від H2 до Au – 100%.
Тобто, це означає, що метал який знаходиться у ряду напруг до при електролізі розчинів ми не одержимо, а буде виділятися
– С –
А тепер у розчині солей є усі іони металів, який з них буде відновлюватися першим при електролізі?
Першим золото Au, а потім P , …. останнім
Потенціал розкладення. Перенапруження.
Для того, щоб електроліз проходив із помітною швидкістю, на клемах ванни треба підтримувати певну напругу, не меншу чим ЕРС утворюваного гальванічного елемента.
Та найменша величина електричного потенціалу, при якій струм повинен надійти у ванну, щоб забезпечити протікання процесу електролізу називається потенціалом розкладення, напругою розкладення, вольтаж.
Ці величини можна найти у таблиці потенціали розкладання
Процеси, що проходять у гальванічному елементі і при електролізі мають один характер – це окисно відновні процеси, але спрямовані у різні сторони. Тому для електролізу необхідна така напруга, яку дає гальванічний елемент, а краще, ще більша.
Наприклад, проведемо електроліз . Потенціал його розкладання Ерозк. дп. = 1,85 (з табл.). ЕРС такого гальванічного елемента:
– Е = Е –
Різниця між потенціалом розкладання і ЕРС гальванічного елемента називається перенапругою.
Еп = Ерозкл. – розкл. ; Е = 1,85 – 1,61 = 0,24 В
(дп) (теор)
Мінімальний потенціал на електроді, при якому починається процес відновлення катіонів металу називається критичним потенціалом (Екрит. ).
Перенапруга при електролізі може досягати значної величини, що приводить до втрати значної кількості енергії.
Явище поляризації
+ А К
![]()
Проведемо нікелювання чайної ложечки. У ванну із розчином опускаємо ложечку, підключаємо до неї від випрямника а + до вугільного електроду. Даємо напругу 36 В. А тепер давайте на декілька хвилин збільшимо напругу до 50 В. Так як у ванні будуть іони і
→
Н О →
то при такій напрузі іони водню, які у 59 разів легші нікелевих будуть перші досягати ложечки і відновлюватися на ній. Вони покриють тонким шаром (водневою подушкою) ложечку і таким чином припинять доступ іонам
Нікелювання припиняється, тому що виникла поляризація. Щоб її зруйнувати треба поміняти на декілька хвилин клеми. А потім знову зробити як було. Цим самим можна знову почати нікелювання.
Може відбутися поляризація по другому. На клемах гальванічної ванни 36 В, а нікелювання не йде. У цьому випадку розчин не підкислили тому утворився осад,
→ ↓
який тонкою плівкою покриє ложечку і припине доступ іонам . Тому нікелювання не йде. Щоб воно відбулося треба додати , для розчинення осаду.
→
Застосування електролізу
Електроліз знайшов широке застосування у різних галузях промисловості.
Гальванотехніка – при допомозі електролізу одержують метали із солей, проводять нікелювання, сріблення, золотіння.
Методом гальванопластики виготовляють бюсти і статуї, наносять товсті покриття на метали, так відновляють деталі.
Ведуть очистку води, одержують луги, важку воду, захисні плівки від корозії.
Шляхом електролізу проводять фарбування металів, поліровку, заточування і т.п.
Лекція 12. Акумулятори
План
1. Акумулятори кислотні і лужні.
2. Свинцевий акумулятор.
3. Залізо–нікелевий акумулятор.
4. Срібно–цинковий акумулятор.
5. Газові акумулятори.
Аккумулятори – це прилади, що здатні накопичувати хімічну енергію, яка по мірі необхідності перетворюються в електричну.
Акумулятори являються вторинними гальванічними елементами, так як для перетвореня їх в джерело струму вони зазделегідь потребують зарядки.
Акумулятор сам не виробляє електричний струм, він може його накопичувати (акумулірувати) при зарядці, а потім при необхідності, розряджуючись, віддавати. Вони мають більший термін служби, чим гальванічні елементи, які при витрачені хімічної енергії становляться непридатними. Хімічну енергію акумулятора можна відновити при зарядці. Він видержує декілька сотень циклів зарядка – розрядка, чим самим вигідно відрізняється від гальванічних елементів.
Практичне значення мають такі типи акумуляторів:
Кислотні (свинцеві) і лужні (залізно–нікелевий, кадмієво–нікелевий, срібно–цинковий і др.).
Вони є джерелами струму для стартерів двигунів внутрішнього згоряння, надають рух електрокарам, використовуються для аварійного освітлення тощо.
Свинцевий акумулятор
Зараз свинцеві акумулятори роблять тільки сухо зарядженими. Це значить: спочатку його треба зробити, потім зарядити, висушити і довести до нормального виду. А тепер все по – порядку.
![]() Свинцевий акумулятор роблять із свинцевих гратчастих пластин, заповнених активною масою із оксиду свинцю ( ). Пластини з‟єднуються через одну, а щоб вони не замикали, між ними установлюють пластмасові прокладки (сепаратори) і поміщають у пластмасову банку. Заливають електроліт – % розчин . Щільність
Свинцевий акумулятор роблять із свинцевих гратчастих пластин, заповнених активною масою із оксиду свинцю ( ). Пластини з‟єднуються через одну, а щоб вони не замикали, між ними установлюють пластмасові прокладки (сепаратори) і поміщають у пластмасову банку. Заливають електроліт – % розчин . Щільність
– 1,32 г/см (На півдні України – 1,27 г/см3 ). Оставляють на 2 години, щоб активна маса ( ) прореагувала з електролітом ), перетворюючись у нерозчинну сіль
→ ↓
Виявляється, що пластини однакові: були ; активна маса після реакції . Тому між ними різниці потенціалів не буде. Щоб акумулятор почав давати струм, його треба зарядити.
Заряджають струмом нормальної величини (у 10 разів менше
ємності акумулятора) протягом 6 годинДля цього від випрямляча подаємо постійний струм, під дією якого (насильно) йде реакція.
– + 2ē → о –
– 2ē→ –
зар.
Сумарне: 2 ↔
розр
У результаті зарядки акумулятора катодні пластини перетворюються в чистий або губчатий свинець , анодні в диоксид свинцю ( ) і йде накопичення сірчаної кислоти.
Таким чином, електроди маючи різні окисно–відновні властивості і поміщені в електроліт , будуть вести себе як гальванічний елемент.
Потім ведуть розрядку акумулятора протягом 4 годин, струмом нормальної величини, міняючи клеми. Тепер акумулятор почне робити, як гальванічний елемент Електрони від катода почнуть рухатися до аноду.
) К 2ē + – →
( + ) А + 2ē →
Сумарне: ↔
При цьому катодні (їх на 1 пластину більше, ніж анодних) та анодні пластини перетворюються в сульфат свинцю і йде утворення води.
Процес зарядка – розрядка роблять 3 рази (щоб акумулятор набрав свою ємність). Четвертий раз заряджають, виливають електроліт, промивають дистильованою водою, висушують гарячим повітрям і приводять до нормального стану.
Свинцевий акумулятор ще називають кислотним або стартерним. Кожна банка дає струм . ККД = 85%.
Кислотні акумулятори мають більший струм розрядки, ніж лужні, тому приміняються як стартерні; більшу напругу і ємність; більший К.К.Д.
Недоліки: велика вага; саморозряд і зменшення ємності; бояться перевантаження; вимогливий до навколишнього середовища.
Лужні акумулятори
До лужних акумуляторів належить залізо–нікелевий.
Він зроблений із стальних градчастих пластин із яких катодні пластини заповнюються активною масою із стружки або ошурок заліза, спресованих з оксидом кадмію ( ). Анодні заповнюються активною масою із оксиду, а частіше з гідроксиду нікелю ), з добавкою 20% графіту, для кращої електропровідності. Їх на одну пластину більше, ніж катодних. Між пластинами знаходяться пластмасові сітки (сепаратори), щоб вони не замикали. Пластини поміщають в стальну банку. Електролітом служить 23% розчин КОН або з добавкою
(для збільшення терміна служби). Щільність 1,19 – 1,21 г/см о С (при температурі – о С щільність повинна бути 1,27 – 1,30 г/см ). При розряджені акумулятора мають місце слідуючи процеси:
) К – – – →
– – →
розр
↔ (сумарне)
зар.
З цього видно, що при розряджені активна масса катодних пластин перетворюються у гідроксид залізу (11) , анодних – у гідроксид нікелю (11).
При заряджені катодні – у залізо , анодні у гідроксид нікелю (111), тобто, набувають свого первісного становища.
Кожна банка дає струм 1,35 ККД
Лужні акумулятори не вимогливі до зовнішнього середовища, майже не піддається саморозряду, не бояться перевантаження; міцність конструкції.
Недоліки: вуглекислий газ, який знаходиться в повітрі, сполучається з електролітом, зменшуючи ємність; напруга, ємність і К.К.Д. менші, ніж у кислотного.
До недоліків кислотних і лужних акумуляторів слід віднести їх невелику питому ємність (це ємність відносно ваги однієї банки). У кислотних 8 а ч/кг; лужних – 3 а ч/кг. А саме головне – неможливість використання при низькому атмосферному тиску, тобто на великій висоті. Цих недоліків майже нема у срібно – цинковому акумуляторі.
(продовження)
Срібно – цинковий акумулятор
У цьому акумуляторі катодними пластинами, , служить цинк або оксид цинку ( або
Анодними – срібло або перекис срібла ( ). Електролітом являється 25%
(щільність 1,4 г/см ). Кожна катодна ( ) пластина знаходиться в пакеті із целюлозної речовини, яка має велику проникаючу здатність. Анодні пластини (+) поміщаються в капронову тканину, стійку до лугів. Це охороняє пластини від короткого замикання і забезпечує достатню площу прилягання пластин з електролітом (мала кількість електроліту) . Пластини щільно прижимають одну до одної і ставлять на дно пластмасової банки. Тому акумулятори мають невеликі розміри і велику ємність. Крім цього, його можна використовувати в любому положенні – горизонтальному або вертикальному. (При зарядці – тільки у вертикальному).
Заряджають акумулятор напругою 2,1 В протягом 20 годин. Допускається заряд протягом 15 хвилин струмом 70 – 80% його мінімальної ємності. Але краще заряджати 10 – 20 годин.
Срібно – цинкові акумулятори мають малі габарити і вагу; велику величину розрядного струму і ємність, яка зберігається в широкому інтервалі температур; добре витримують великі висоти.
Недоліки: один із основних довго ведуть зарядку
Вивчаючи основні типи акумуляторів, приходиш до висновку, що ще не на всі запитання знайшли відповідь. Особливо це стосується свинцевого та залізо – нікелевого акумуляторів. Давайте поміркуємо і на деякі з них відповімо.
1. Що означає напис на акумуляторі: 6 СТ – 55 А?; 6 – банок; СТ – стартерний; 55 – А – ємність; 55 Ампер годин.
На зарубіжних акумуляторах :12V, 55Ah, RC 90 min, LOAD TEST 200A; CCA (-18C); BCI 400, IEC 275, DIN 255.
Це означає: 12 12 вольт, 55 – ємність, резервна ємність 90 хвилин скільки можна проїхати на акумуляторі при непрацюючему генераторі, –
навантажуючий тест (струм навантаження при запуску двигуна; після 15 секунд провірки під навантаженням акумулятор повинен давати 9,5 при о С. Чим менше навантажуючий тест, тим менша ємність акумулятора, а значить менший двигун він повинен крутити);
– струм холодного пуску, для цього акумулятор витримують при температурі 18о С.; струм холостого пуску вимірюється по 3 м методикам: 255, тобто 30,
60, 150 сек; 7,2; 8,4; або 6 кінцева напруга. 2. Як можна відремонтувати акумулятор?
Останнім часом сухо заряджені акумулятори роблять так: катодні пластини із губчастого свинцю (Pb), анодні – із диоксиду свинцю (PbO2 ). (Продаються у магазинах). 3. Як готують сухозаряджений акумулятор до експлуатації?
Щоб акумулятор почав давати струм, треба залити електроліт не менш 2-х годин вони насичуються. Потім, добрий хазяїн після цього підзаряджає акумулятор. 4. Від чого залежить ємність акумулятора? Від площі активної маси.
5. Чому у свинцевому акумуляторі негативних пластин на одну більш ніж позитивних, а у залізо – нікелевого навпаки?
Для збільшення ємності, тому що збільшується площа активної маси.
6. Як визначити ємність акумулятора?
Його треба зарядити, потім навантажуючою вилкою розрядити (8 - 10 годин) , засікаючи час і по формулі: Q = I * t, де Q - ємність ; I - розрядний струм ; t - час в годинах;
7. Як можна визначити, що акумулятор заряджений або розряджений?
По кипінню Коли він розряджений, то бере на себе зарядку і кипіти не буде, а коли заряджений через декілька хвилин почне кипіти.
Навантажуючою вилкою Коли кожна банка буде показувати напругу більше 1,8 V – він заряджений, менше – розряджений.
По щільністі (ареометром) Коли щільність електроліту 1,25 г/см3 і більше – він заряджений, нижче – розряджений. 8. До якої напруги можна розряджати акумулятор? До 1,8 V, нижче – йде сульфітація пластин.
9. Краще акумулятор “перезарядити чи недозарядити”?
Його не перезарядиш (йде кипіння) – а від недозарядки буде йти сульфітація пластин. Тому краще „перезарядити”. 10. Краще акумулятор підзаряджати струмом малої величини чи великим?
Треба починати з малого і постійно прибавляючи, довести до нормального, тобто у 10 разів менше від ємності. Коли великим спочатку, акумулятор закипить і може вибухнути. 11. Як буде змінятися щільність електроліту при заряджені і розряджені акумулятора?
При заряджені буде збільшуватися, при розряджені - зменшуватися.
12. Що таке “кипіння” акумулятора?
Йде електроліз електроліту, на катоді виділяється водень, на аноді – кисень (гримучий газ).
Створюється уявлення, що електроліт кипить. 13. Що таке сульфатація пластин?
Це коли дрібнозернистий порошок PbSO4 перетворюється у крупнозернистий.
14. Коли наступає сульфатація пластин?
14.1. Це спостерігається тоді коли довго не підзаряджати акумулятор.
14.2. Коли реле настроєно на малу напругу – 12V, а треба 14 – 14,3 V.
14.3. Коли оголяються пластини (википає або випаровується електроліт і т. д.).
15. Як краще зберігати акумулятор?
Краще зберігати новий сухозаряджений акумулятор, заливши в нього 4% розчин борної кислоти; хуже – сухим; а ще хуже - з електролітом (буде йти саморозряд, треба підзаряджати).
Газові акумулятори
Активними речовинами у газових акумуляторів являються гази, які утворюються при його заряджені та розряджені.
Пластинами у таких акумуляторів являється активоване вугілля, яке поміщають у пластмасову банку. Електролітом служить 15% . При заряджені акумулятора йде електроліз електроліту.
→
→
→
На катоді (–) виділяється і поглинається пластиною, на аноді , який теж поглинається активованою пластинкою. Тепер одержуємо: ніби – то катодна пластина зроблена з водню, а анодна з хлору. Між ними різність потенціалів 2,5
При експлуатації такого акумулятора електроліт треба періодично міняти, так як в ньому йде накопичення гідроксиду натрію.
Приміняються такі акумулятори в стаціонарних установках.
Швидкий розряд і навіть коротке замикання не впливають на стан акумулятора Недолік – швидкий саморозряд, особливо при вібрації.
Лекція 13. Корозія металів і методи захисту від корозії
План.
1. Основні види корозії.
2. Хімічна та електрохімічна корозія.
3. Фактори, які впливають на корозію
4. Методи захисту від корозії.5. Інгібітори корозії.
Основні види корозії
Одним з факторів, що знижують надійність і машин та обладнання, є корозія металів. Більш за всіх страждають від корозії залізо та його сплави. Знайдено, що кожен рік губиться від корозії біля 25% виплавлених за такий самий строк металів і сплавів. Але метали від корозії не є єдиною шкодою, що вона робить: корозія робить великі предмети нездатними до використання.
Щорічні втрати від пожеж, повенів, ураганів, землетрусів не перевищує самих малих втрат від корозії.
В усьому світі кожна 3 я домна працює на корозію.
Прямі втрати металу складають тільки частину усіх затрат, які включають простій устаткування, зниження якості продукції, з аваріями і навіть людськими жертвами.
Чому метали піддаються корозії? В цьому випадку хочеться задати протилежні запитання.
Чому метали так довго не руйнуються і служать людям роками і століттями?
Майже всі метали одержує людство із руд і солей шляхом відновлення у доменних печах або при електролізі. Але закони природи завжди в дії. Цей самий метал знову намагається повернутися в те саме середовище, у якому він був до цього, тобто у свій первинний стан.
Тільки благородні метали в природі знаходяться в елеметарному стані: 112 кг, 13,5 т, 420 т.
Корозія – це необхідний по хімічним законам перехід металів у натуральне для нього у земних умовах хімічне становище.
І все ж таки, чому такі великі втрати металу?
1. По перше, в усіх країнах метал залишається основним конструкційним матеріалом у техніці.
2. По друге, на швидкий ріст втрат сильно впливає сфера використання металу.
Залізничний транспорт, комунальне господарство, верстатобудування, машинобудування, кораблебудування, сільське господарство і ін.
3. По третє, дуже впливає на становище конструкції агресивність середовища (вода, повітря, рН землі і т.д.).
4. Недооцінка важливості цієї проблеми.
У результаті, вищі заклади випускають спеціалістів, які не дуже добре знають основні принципи корозійних процесів і тому не до оцінюють її результати.
Корозією називається хімічне або електрохімічне зруйнування металів під дією навколишнього середовища.
Бувають такі типи корозії:
1. Рівномірна. 2. Плямиста.3. Міжкристалічна. 4.Пітінг. та ін.
Корозія буває двох видів:
1. Хімічна та 2. Електрохімічна.
Хімічна та електрохімічна корозії
В залежності від агресивності середовища розрізняють хімічну і електрохімічну корозію .
Хімічна корозія – це руйнування металу в середовищі неелектроліту в результаті
хімічної взаємодії.
Вона поділяється на газову і рідинну
Газова – відбувається у газах (повітря, і ін.)
Рідинна – проходить у рідинах, які не проводять електричний струм (нафта, керосин, бензин, масла і т.д.).
Електрохімічна корозія – це зруйнування металу в середовищі електроліту з виникненням у середині системи електричного струму.
До цієї корозії відносяться:
Атмосферна корозія.
Грунтова корозія.
Водна корозія.
Біокорозія.
Інші корозії.
Вона ще може бути гальванокорозією і електрокорозією Гальванокорозія ділиться на макро , мікро і сублімікрокорозію.
Макро – можна бачити просто так.
Мікро – під мікроскопом.
Субмікро – в ультрамікроскоп.
До електрокорозії відноситься корозія під дією блукаючих струмів.
Електрохімічна корозія має місце у розчинах кислот, лугів, солей, морській воді,
у вологому повітрі, якій містить розчинені гази. Це найбільш поширений вид корозії. Електрохімічне руйнування металів обумовлене появленню електричного струму в середині системи.
Метали, що застосовуються у техніці, містять домішки різних металів. Внаслідок зіткнення їх з агресивним середовищем утворюються гальванічні елементи, в яких більш активний метал безперервно руйнується, переходячи у розчин електроліту у вигляді катіонів. Тому електрохімічна корозія характеризується анодним окисленням металів .
Роботу вищезазначених гальванічних елементів можна пояснити на основі величин стандартних електродних потенціалів відповідних металів. Наприклад, під час контакту заліза з міддю виникає гальванічний елемент, в якому анодом є залізо, а катодом – мідь(мал.).
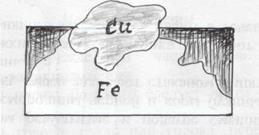
Схема корозії заліза з включенням міді.
Внаслідок роботи такого елементу мають місце такі окисно – відновні процеси:
На аноді 2Fe + 4ē → (окислення)
Атоми заліза віддають електрони і переходять у розчин у вигляді Fe
На катоді О + 2Н О + 4ē → 4ОН (відновлення)
Електрони, що переходять з аноду на катод, відновлюють кисень, розчинений у плівці води на поверхні катоду.
Вторинні процеси: →
→
Іони Fe сполучаються з іонами ОН утворюючи білу іржу, яка окислюється киснем повітря у присутності вологи до бурої іржи Fe(OH) . Склад іржи може змінюватися в залежності від умов її утворення. Частіш за все вона має склад Fe ·Н О або 4Fe(OH) . Крім того іржа містить Fe
Корозія, яка супроводжується відновленням кисню, має місце у воді, повітрі і ґрунті. Коли у середовищі присутня значна кількість іонів водню, то окислювачем є іони Н (корозія у кислому середовищі):
2Н +2ē → Н
Майже всі метали у техніці є неоднорідними і наявність у них різних домішок веде до виникнення на поверхні великої кількості мікрогальванічних пар. Роль електроліту виконує гігроскопічна волога, що утворює на поверхні металу плівки товщиною у декілька десятків молекулярних шарів.
Той компонент окисленого середовища, який здатний поглинати загублені металом електрони, називається деполяризатором .
Якщо деполяризаторами є катіони водню, то має місце воднева деполяризація, а якщо атоми кисню – киснева деполяризація.
Атмосферна корозія
Механізм цієї корозії заключається в слідуючому: На металі з допомогою пилу, грязі, вологи створюється рідинна плівка (електроліт). Метал починає руйнуватися, тобто ржавіти. Між різними включеннями і металом утворюється гальванічний елемент, де анодом служить метал, а катодом той самий пил. Розберемо корозію заліза.
А 2 4ē →
+ 4ē →
→
→
(мікрокорозія) (іржа)
На практиці найчастіше зустрічаються не чисті метали, а сплави або контакти двох металів.
У таких випадках утворюється гальванічна пара із двох металів (макрокорозія). Наприклад оцинковане залізо. Анодом буде
А 4ē →
+ 4ē →
→
У цьому випадку руйнується (розчиняється), а залізо охороняється від іржи. Грунтова корозія
Складною різновидністю корозії являється ґрунтова. Тут грають роль фізичні і хімічні властивості ґрунту, волога, рН ґрунту, повітропроникність, електродний потенціал металу, який знаходиться у контакті з ґрунтом і т. д.
Водна корозія
Водна корозія також залежить від активності металу з якого зроблена конструкція, рН води, її жорсткість, забрудненість і т. д.
Біокорозія
Біокорозія проходить за рахунок продуктів життєдіяльності мікроорганізмів, які можуть виробляти СО , Н , СН і т. д.
Корозія під дією блукаючих струмів.
Ця корозія виникає там де проходить електричний струм. Більш усього це під лініями великої напруги, під трамвайними коліями, трансформаторними будками і т. д.
Руйнування йде дуже швидко, коли струм постійний. Фактори, які впливають на корозію
На корозію впливають дуже багато факторів:
1. Активність метала. Поглянемо на таблицю напруг металів (див. „Гальванічні елементи”) і стане ясно з якого металу краще зробити конструкцію: з натрію – вона у вологому повітрі вибухне, з алюмінію – легка, а треба важку, з золота – дуже дорога, давайте з заліза і все буде добре.
2. Структура метала . Сплави з однорідною структурою більш стійкі чим з неоднорідною. Наприклад, бронза, латунь, сплави золота і срібла, золота і міді.
3. Механічна деформація . Наприклад, зігнута труба. Внутрішній шар труби стискається, зовнішній – розтягується. У цьому місці і почнеться корозія. Або давайте ударимо молотком по трубі, зробимо ум ятину і подивимося, що буде.
4. Поверхність метала . Полірований метал хуже піддається корозії, ніж шорсткий. Наприклад, колона, яка знаходиться недалеко від столиці Індії. Вона зроблена з чистого заліза і добре відшліфована руками рабів, майже не піддається корозії.
5. Роль середовища . Грає роль середовище у якому знаходиться предмет або конструкція (кислі дощі; грунт лужний, кислий; клімат сухий , вогкий і т.д.).
Методи захисту металів від корозії
Існують 3 метода захисту металів від корозії.
Неметалічний.
Металічний. Хімічний.
Неметалічний метод - заключається у тому, що метал можна захистить фарбами, лаками, змазуванням маслами, вазеліном, покривати бітумом, емалями, гумкою (гуміровання), цементом (торкретірування) і др..
Металічний метод – заключається у тому, що метал захищають металами. Для цього маємо декілька способів металічного захисту:
Гальванічний , який заключається у тому, що у гальванічній ванні, шляхом електролізу, роблять хромування, нікелювання, сріблення, золочення.
2. Гаряче покриття. Це, коли у розплавлений метал занурюють обезжирений метал. Наприклад, оцинковане залізо, луджене залізо.
3. Спосіб металізації заключається у тому, що на холодний предмет (конструкцію) при допомозі металізатора наносять розплавлений метал (частіше всього це алюміній, цинк, нікель, мідь). Наприклад, станина мікроскопа, і т.д.
4. Спосіб алітіровання, який заключається у тому, що на гарячу конструкцію за допомогою металізатора наносять розплавлений метал У цьому випадку одержуємо поверхневий сплав. Хімічний метод захисту можна провести 3–ма способами:
Оксидування (вороніння) відбувається при допомозі кисню (нагани, пістолети,
гвинтівки, ствол кулемета, пушки). При цьому розжарений метал поміщають у масло, де він поступово охолоджується.
2.. Пасивування (пасивація) проводять концентрованою азотною кислотою (Н Конструкцію поміщають в кислоту, видержують декілька годин. При цьому утворюється нітридна плівка. Можна це робити за допомогою або під тиском.
Фосфатування з допомогою ортофосфорної кислоти Н РО . Краще робити 50%
кислотою, добавляючи на кожні 100 мл по 5 г сульфату цинку. Утворюється фосфідна плівка. Цей метод застосовується і сьогодні у аерозолях проти корозії.
Другі методи захисту
Катодний і анодний захист.
Це металічний захист:
Анодний коли конструкцію покриваємо більш активним металом (оцинковане залізо).
Катодний коли конструкцію покриваємо менш активним металом (луджене залізо).
Існує протекторний спосіб захисту. Він заключається у тому, що через деяку відстань до конструкції прикріпляють більш активний метал (частіше або ). Це до нефтепроводу, газопроводу водопроводу (через 50 м), кораблів, підводних човнів (1 – 2 м).
Електрозахист заключається у тому, що від випрямляча до конструкції підключаємо негативний полюс ( ), а позитивний (+) заземляємо.
Захищають метал від корозії інгібіторами – це речовини, які зменшують корозію. До них відносяться: карбонати, фосфати і хромати.
Активатори корозії -
збільшують корозію. Це флориди, хлориди, сульфати, нітрати. Зменшують корозію роблячи сплави, які важко піддаються корозії.
Лекція 14. Загальна характеристика металів
План.
Фізичні властивості металів. Одержання металів.
Хімічні властивості металів.
Значення металів для людини.
Усі елементи періодичної системи Д.І.Менделєєва умовно розділяються на дві групи: метали і неметали. Де 75% із усіх елементів займають метали.
Метали знаходяться у головних групах, а у побічних знаходяться метали і неметали.
До металів у більшості випадків відносяться елементи, в атомах яких на зовнішньому енергетичному рівні знаходиться один, два або три валентних електрони. Це: усі s елементи (за виключенням водню і гелія). р елементи ІІІ А групи (за виключенням бора).
деякі р елементи IV A, V A, VI A, VII A груп. d і f елементи.
Фізичні властивості металів
Усі метали, за винятком ртуті, при нормальних умовах, являються твердими речовинами, які мають характерний блиск, а в подрібненому стані, за винятком магнію і алюмінію мають чорний або темно–сірий колір.
У техніці метали ділять на легкі – густина яких < 5г/см3 і важкі – густина яких >
3 .
5г/см
До легких металів відносяться:
До важких металів відносяться:
Самий легкий – , густиною < 0,53 г/см
Самий важкий – > 22,5 г/см
Метали володіють ковкістю, електро – і теплопровідністю . Самим пластичним металом являється золото. Із нього можна виготовляти листи, товщиною 0,003 мм, витягувати проволоку тонше волосся. 1г – 3 км.
Найбільшою електропровідністю володіє , потім ; меншою – і так же розподіляється і теплопровідність.
Під час нагрівання металів їх електропровідність зменшується, а при охолодженні – зростає; біля абсолютного нуля вона прямує до нескінченності – явище надпровідності.
У вузлах кристалічних граток металів знаходяться позитивно заряджені іони і нейтральні атоми, а між ними – вільно рухаються електрони. З цим рухом і зв‟язана висока електро – і теплопровідність.
Метали відрізняються один від одного по твердості:
Самі м‟які– і – їх можна різати ножем.
Самий твердий –
Твердість являється цінною якістю для металів, особливо при побудові різних конструкцій. Метали діляться на тугоплавкі і легкоплавкі.
Легкоплавкі – –
Тугоплавкі:
Самий легкоплавкий – плавиться у руках.
Самий тугоплавкий – –
У промисловості метали ділять на чорні і кольорові – усі останні.
А ще метали бувають:
Рідкі і др..
Рідкоземельні , ітрій, лантаноїди. Благородні:
Радіоактивні , актиноїди.
Метали по хімічним властивостям відносяться до 3–х груп:
Лужні і лужноземельні. (1 і 2 групи, главні підгрупи).
Амфотерні.
Типічні метали.
По сімействам:
Одержання металів
Тільки благородні метали зустрічаються у звичайному стані. За весь період життя людства було знайдено:
– кг, – ,5 т, – т – ∞
В основному метали знаходяться в природі у вигляді сполук: солей, оксидів і основ.
Найбільш розповсюджені оксиди металів : – гематит, – магнітний залізняк, – куприт, – корунд, – каситерит.
Багато в природі зустрічається і сульфідів металів: заліза, нікелю, міді, цинку, свинцю і ін.
Розповсюджені також солі металів у вигляді карбонатів, силікатів, фосфатів, сульфатів.
Розчинні солі металів знаходяться у воді океанів, морів, озер, річок.
Метали входять до складу гірських порід і мінералів, які ще називаються рудами.
Руди є головним джерелом одержання металів.
1. Коли метали знаходяться у рудах у вигляді окислів, то їх одержують шляхом відновлення вуглецем або СО:
→
2. Можна одержати метал відновленням більш активним металом:
→
алюмотермія
3. Випалюванням сірчаних руд з послідуючим відновленням окислів металів вуглецем або воднем.
→
→
Найчистіші метали одержують шляхом електролізу із розплаву солей.
→
→
→
5. За допомогою зонної плавки отримують дуже чисті метали і напівпровідники.
Сублімація. Цим методом одержують ще більш чисті метали. Їх спочатку
перетворюють у газоподібний стан, а потім шляхом охолодження кристалізують.
Хімічні властивості металів
У хімічному відношенні метали характеризуються здатністю віддавати електрони і перетворюватися у позитивно заряджені іони. Тому вони завжди виступають як відновники.
Ме – – → Ме + (відновник)
Окислювачами можуть бути тільки іони металів.
Са + 2е → Са (окисник)
Відновні властивості металів у періодичній системі збільшуються по групах зверху вниз, а по періодам справа – наліво.
Здатність віддавати електрони у металів неоднакова. Чим легше метал віддає електрони, тим активніше і більш енергійно він взаємодіє з неметалами та іонами інших металів.
За ознакою активності всі метали розташовуються у ряді, що називається рядом активност або рядом напруг
У ряді напруги стоїть також водень, який віддає електрони і утворює позитивно заряджений іон, тобто поводить себе як метал.
З ряду напруги можна зробити три основних висновки, щодо хімічної активності металів:
1. Чим нижча алгебраїчна величина електродного потенціалу, тим кращим відновником він являється. Тим більша його хімічна активність і навпаки.
2. Більш активний метал витісняє із солей менш активний.
. Метали, які знаходяться в ряду активності до водню, витісняють його із кислот.
Метали, які знаходяться після водню можуть реагувати з кислотами, але не витіснятимуть його .
Концентрована сірчана кислота взаємодіє майже із усіма металами незалежно від їх розташування у ряді напруги, але водень при цьому не виділяється. Продукт, до якого відновлюється кислота, залежить від відновної активності металу. Наприклад, при взаємодії з міддю – відновлюється до диоксиду сірки (ІV) SO , з цинком – до вільної сірки, з кальцієм – до сірководню.
Специфічно взаємодіє з металами азотна кислота HNO . Навіть її розведені водні розчини окислюють метали без виділення водню. Продукт відновлення нітрат іона залежить і від концентрації азотної кислоти і від активності металу, що з нею взаємодіє.
→
→
→
→
А тепер давайте більш докладніше зупинимося на хімічних властивостях:
Метали можуть реагувати з металами, при високій температурі, з утворенням однорідних сплавів:
Метали при > з‟єднуються з воднем утворюючи гідриди:
…(де –
З бором, утворюючи бориди
З вуглецем, утворюючи карбіди:
С; ….
З азотом, утворюючи нітриди:
→
6. З фосфором – фосфіди:
З киснем багато металів окислюються, утворюючи оксиди:
→ СаО; …
8. З сіркою – утворюючи сульфіди:
. З галогенами утворюючи солі:
Са + СІ → СаСІ АІСІ
. Активні метали реагують з водою:
→ ↑
→ ↑
Метали, які знаходяться у ряду активності до водню реагують з кислотами,
утворюючи водень.
→ ↑
Які знаходяться після водню реагують з кислотою, але водень не отримується.
→
Метали реагують з солями де більш активний метал витискає із солі менш активний:
→
. Амфотерні метали реагують з лугами:
→ ↑
. Вищі оксиди малоактивних металів мають як основні так і кислотні властивості.
![]()
![]() Основні амфотерні Кислотні
Основні амфотерні Кислотні ![]()
Те, що метали приміняються майже в кожній сфері діяльності людини – це ми дуже добре знаємо
Лекція 15. Високомолекулярні сполуки
План.
1. Коротка характеристика і отримання полімерів.
2. Фізичні властивості.
3. Класифікація полімерів.
4. Природні високомолекулярні сполуки.
5. Штучні полімери.
6. Синтетичні полімери.
7. Елементополімери.
Характеристика і отримання полімерів
Органічні речовини – це сполуки вуглецю, атоми якого зв‟язані з атомами других елементів ковалентними мало полярними зв‟язками.
Молекулярна вага органічних сполук коливається в широких межах. Наприклад, молекулярна вага низькомолекулярних сполук не перевищує декілька сотень вуглецевих одиниць (в.о.). Високомолекулярні сполуки мають молекулярну вагу більше 10000 в.о. До них відносяться: білки, каучук, вуглеводи, клітковина, різні хімічні волокна і т. д.
Високомолекулярні сполуки відрізняються характерними особливостями: вони не мають визначеної температури плавлення, малорозчинні, мають високу міцність і еластичність, витягуються у нитку.
Молекули високомолекулярних речовин відрізняються від низькомолекулярних трьома особливостями:
Великою молекулярною вагою.
Ланцюговою будовою.
Гнучкістю.
Високомолекулярні сполуки ще називаються органічними полімерами.
Полімери можна отримати двома способами:
Спосіб полімеризації.
Спосіб поліконденсації.
Спосіб полімеризації заключається у тому, що розриваються подвійні або потрійні зв‟язки у органічних сполуках.
Н С = СН → Н С – СН
А = А → А – А
Тут ми маємо однаковий склад полімерних ланцюгів.
Спосіб поліконденсації заключається у тому, що при утворенні полімеру йде звільнення низькомолекулярного продукту (Н О, СО,
(Н А) + (Б ОН) → А – Б + Н О
При поліконденсації структурні ланцюги можуть бути різні.
Кількість ланцюгів ( ) залежить від різних факторів: тиску, температури, каталізатора. Від величини ланцюгів або від їх кількості залежить властивості полімерів.
Для поліетилену: при = 20 одержуємо в‟язку рідину, при = 100 одержуємо воскову речовину, а при = 1000 отримаємо твердий продукт.
Фізичні властивості
Речовини з лінійною структурою майже завжди гнучкі, еластичні, при високій температурі розм‟якшуються.
Міцність полімеру збільшується, коли в його утворенні беруть участь молекули різної довжини.
Наявність в полімері бокових ланцюгів призводе до збільшення пружності, пластичності, міцності.
На фізичні властивості полімеру діє поперечний зв‟язок. При його присутності розчинність зменшується, знижується і пластичність.
Класифікація полімерів
Класифікація полімерів складна: по хімічній природі, відношенню до температури, способу отримання і т.д.
По хімічній природі, складу ланцюгів та їх конфігурації бувають такі полімери:
Гомополімери – це такі, які мають одну і ту саму хімічну природу.
При цьому вони можуть бути розгалужені (лінійні) і привиті (прищеплені), але бокові ланцюги менш ніж головні.
Сополімери – це продукти спільної полімеризації або поліконденсації мономерів
різної природи.
Вони можуть бути лінійні, привиті і блок – сополімери, коли об‟єднуються в ланцюги десятки тисяч блоків. При цьому можуть бути органічні і неорганічні кільця.
Велике значення мають сітчасті сополімери, вони ніби то сточуються (зшиваються) між собою поперечним зв‟язком.
По відношенню до температури полімери діляться на: термопластичні і термореактивні
Термопластичні – це смоли або пластики, які здібні розм‟якшуватися і зберігати в‟язко текуче становище при високій температурі. Але при охолодженні вони твердіють.
Наприклад, плексиглас, поліетилен і ін.
Термореактивні – це смоли або пластики, які при високій температурі перетворюються у в‟язко текуче становище, але при охолодженні вони змінюють властивості. Наприклад, ебоніт, формальдегідна смола. Пластмаси по своєму складу діляться на:
Прості – утворені однією смолою.
Складні – утворені декількома компонентами. а) зв’язуюча речовина – основна;
б) наповнювачі – компоненти, які підвищують механічну стійкість (графіт, мука, тканина);
в) пластифікатори – добавки, які надають пластмасі еластичність, гнучкість і т.д.
г) барвники – забарвлюють пластмасу.
Природні високомолекулярні сполуки
До них відносяться білки, крохмаль, клітковина та каучук.
Білки – складаються із багатьох кілець зв‟язаних між собою пептидним зв‟язком.
С – або СО – –
О Н
Це залишки різних амінокислот зв‟язаних між собою. Молекулярна вага від десятків тисяч до кілька мільйонів в.о.
Білки мають спіральну конфігурацію.
Крохмаль і клітковина це вуглеводи природного походження. Формула (С Н О Відрізняються вони характером будови ланцюгів.
У крохмалю ланцюг сильно зігнутий, зв‟язок – містковий.
У клітковині розташування атомів – лінійне. Крохмаль гідролізується кислотами і ферментами. Клітчата – ні.
Молекулярна вага крохмалю менш ніж клітковини.
Каучук – формула (C5 H8 )n. М. В. 170 –200 тис. в.о. Макромолекули каучуку побудовані ланцюгоподібно. При вулканізації відбувається зшиття молекул каучуку сіркою і утворюється резина (гумка). Коли сірки буде більше 25–30%, каучук перетворюється в тверду речовину чорного кольору – ебоніт. Із ебоніту роблять радіоприлади, медичний інструмент і другі прилади.
Штучні високомолекулярні речовини
Їх одержують шляхом хімічної переробки природних високомолекулярних речовин.
Наприклад, ацетилцелюлоза – складний ефір целюлози і оцтової кислоти [ – –
. Це негорючий матеріал, який широко використовується для виготовлення
кіноплівки, ацетатного шовку і пластмас.
Нітроклітчатка , тринітроклітчатка [ – – піроксилін. Це – ефір
целюлози і азотної кислоти. Застосовується як вибухова речовина. Одержують бездимний порох.
Нітроклітчатка разом з камфорою утворюють целулоїд, з якого одержують кіноплівки, іграшки, скло “триплекс”.
Віскоза – одержують із целюлози і сірки. Із неї роблять целофан, віскозний шовк і т. д.
Синтетичні високомолекулярні речовини
Синтетичну речовину отримують шляхом полімеризації або поліконденсації. Вони ще називаються смолами, які використовуються у народному господарстві.
Наприклад, поліетилен – (СН – СН – . М.В. 60–300 тис. або до 3 млн. в.о. Він має високі електроізоляційні властивості, стійкий до лугів і кислот. При 110 С розм‟якшується, при – С – стає крихким. Розчиняється у бензолі, толуолі, ксилолі, чотирьох хлористому вуглецю і осідає при охолоджені у вигляді порошку.
Використовується в електротехніці, медицині, хімічній промисловості і т. д.
![]() Поліпропілен – –CH2
– CH –
Поліпропілен – –CH2
– CH –
![]() n
n
![]()
Легкий полімер М.в. 150 тис. в.о. міцний, розм‟якшується при 160 – С. Добре формується. Використовується як ізоляційний матеріал, для виготовлення деталей, телефонів, телевізорів.
![]()
![]() Поліізобутилен – – CH2
– C – n
Поліізобутилен – – CH2
– C – n
Він перевищує поліпропілен по еластичності і розчинності. Застосовується для одержання бутилкаучуку, ізоляційних стрічок, клейких матеріалів і т.д.
![]()
![]() Полістирол
СН – СН –
Полістирол
СН – СН –
С Н
М.в. 3 900 тис. в.о.
Безкольорова маса, фарбується у різний колір. Хімічно стійкий. Застосовується для виготовлення різних деталей, акумуляторних банок і т.д.
Полівінілхлорид СН– СН –
![]() СІ
СІ
![]()
![]() Він більш міцний ніж полістирол. Використовується для виготовлення гальванічних ванн, клейонок, плащів, сумок і т.д. Недостача – швидко “старіє”.
Він більш міцний ніж полістирол. Використовується для виготовлення гальванічних ванн, клейонок, плащів, сумок і т.д. Недостача – швидко “старіє”.
Фторопласт – 4 (тефлон) – Ця речовина нагадує парафін. М.в. 142 534 тис. в.о.
Тефлон перевершує навіть благородні метали по стійкості до кислот, лугів, він не розчинюється навіть у “царській горілці”. Предмети із нього мають велику твердість, стійки до стирання. Із нього виготовляють підшипники. Розм‟якшується при 250 С. Добрий ізолятор.
Плексиглас – це тверда, прозора смола, легко підлягає механічній обробці. Розчиняється у дихлоретані. Із нього виробляють скло, шкатулки, вази і т.д.
Фенолформальдегідні смоли
Текстоліт – тканина просочена смолою.
Гетинакс – папір просочений смолою.
Епоксидні смоли застосовуються як добрі клеї, для виготовлення плитки і т.д.
Синтетичні волокна
Капрон – застосовується для виготовлення канатів, штучного каракулю і т.д.
Анід – йде на виготовлення кордних тканин, для авіа – і автопокришок. Пінопласт – застосовується як добрий ізолятор і утеплювач.
Елементополімери
В їх основі находиться атоми вуглецю. В залежності від складання ланцюгів неорганічні елементополімери діляться:
Гомоланцюгові – побудовані із атомів одного елемента.
Гетероланцюгові – із різних атомів
Н Н Н
Наприклад, – – ![]() – – –
– – –![]()
![]()
![]()
Кремній проявляє схильність до утворення гетеро ланцюгових полімерів із сітчастою
структурою. Наприклад, кварц, силікатне скло.
Елементополімери відрізняються від органічних великою міцністю і твердістю.
Застосовуються як напівпровідники, у якості каталізатора, мінеральних волокон, для захисту металів від корозії і т.д.
Основні питання з хімії на які дають відповідь лекції
Тема: Будова атома. Періодичний закон і періодична система елементів Д. І Менделєєва.
1.Назвіть склад атома. Дайте характеристику елементарним частинам: протон, нейтрон, електрон.
2. Теорія Планка. Математичний вираз величини енергії кванта.
3. Постулати Бора.
4. Дайте характеристику 4 х квантових чисел (
5. В чому суть принципу Паулі? Правило Хунта і Клечківського.
6. Написання електронних формул.
7. Як читається Періодичний закон. Дайте йому сучасне тлумачення.
8. Що виражає періодична система: періоди, групи, підгрупи. Порядковий номер елемента.
,
Тема: Хімічний звязок і будова молекул
1.Основні типи хімічного зв зку.
2.Основні положення метода валентного зв язку (ВЗ) і молекулярних орбіталей (МО).
3. Що називається ковалентним зв язком? Енергія звязку.
4.Що таке електронегативність. Енергія іонізації і спорідненості до електрону.
5. Ковалентний полярний і неполярний зв язки.
6. Гібридизація звязку, що це таке? Коли відбувається?
7. Іонний звя язок. Як його можна тлумачити з точки зору електронегативності елементів.
8. Донорно – акцепторний звязок. Як він утворюються.?
9. Водневий звязок. Яким він буває.
Тема: Хімічна термодинаміка.
1. Що вивчає термодинаміка?
2. Які процеси в хімії називаються ізобарними та ізохорними?
3. Що називається екзотермічними и ендотермічними реакціями?
4. Дайте визначення поняттям: тепловий ефект хімічної реакції, ентальпія, ентропія, До чого вони прагнуть?
5. Сформулюйте закон Лавуазьє – Лапласа?
6. Сформулюйте закон Гесса. Наслідок з нього.
7. Ізобарно – ізотонічний потенціал. Енергія Гіббса. Напрямок хімічних реакцій.
Тема: Хімічна кінетика та рівновага.
1. Що вивчає хімічна кінетика?
2. В чому вимірюється швидкість хімічних реакцій?
3. Які фактори впливають на швидкість реакції.
4. Сформулюйте закон діючих мас. Його математичне вираження.
5. Як читається закон Ван – Гоффа. Наслідок із закону.
6. Що називається каталізаторами. Гомогенний та гетерогенний каталіз. Позитивний і негативний каталіз.
7. Сформулюйте принцип ле – Шательє.
8. Куди зміщується рівновага при збільшені концентрації, температури і тиску.
9. Ланцюгові реакції.
Тема: Загальна характеристика розчинів.
1. Що називається розчинами?
2. Класифікація розчинів.
3. Теорія Д. І. Менделєєва и Арреніуса.
4. Що називається концентрацією?5. Способи вираження концентрації розчинів.
Тема. Розчини неелектролітів
1. Процес розчинення. Енергія процесу.
2. Розчинність твердих речовин, рідин і газів. Закон Генрі та Дальтона.
3. Осмос. Осмотичний тиск. Закон Вант – Гоффа.
4. Кипіння. Тиск насиченого пара. 1 закон Рауля.
5. Температура кипіння (ебуліоскопія), температура замерзання (кріоскопія). 2 і 3 закони Рауля.
11. Приготування антифризів.
Тема: Розчини електролітів Електролітична дисоціація
1.Що називається електролітами і неелектролітами?
2.Що називається електролітичною дисоціацією.
3. Ступінь дисоціації. Константа дисоціації. Їх математичне визначення.
4. Фактори, які впливають на ступінь дисоціації.
5. Сильні і слабі електроліти.
6. Дисоціація кислот, основ і солей.
7. Яка залежність між ступенем дисоціації, числом іонів, на які розпався електроліт і коефіцієнтом Ван – Гоффа (і).
8. Дисоціація води.9. Гідроліз солей.
Тема. Окисно – відновні реакції
1. Що називається окисно – відновними реакціями?
2. Що таке відновлювач, окислювач. Процес окислення і відновлення.
3. Важливіші відновлювачі і окислювачі.
4. Ступінь окислення. Чим вона відрізняється від валентності?.
5. Як визначити ступінь окислення?
6. Складання окисно – відновних реакцій методом електронного балансу і іонно – електронним методом.
7. Які реакції відносяться до самоокислення самовідновлення, внутрішньо молекулярне окислення і відновлення, міжмолекулярне окислення і відновлення.
Тема: Ряд напруг металів. Гальванічні елементи.
Чи зарядиться метал у воді, або у вакуумі?
Як виникає подвійний електродний шар?
Що називається електродним потенціалом?
Що таке рівноважний потенціал?
Чи можна змінити потенціал металу, змінюючи концентрацію розчину?
Чи можна виміряти абсолютне значення електродного потенціалу?
По якій формулі визначають електродний потенціал.
Що називається стандартним (нормальним) електродним потенціалом?
Як обладнаний нормальний водневий електрод. Чому дорівнює його електродний потенціал?
На що вказує ряд напруги металів, відносно їх хімічних властивостей? Що називається гальванічним елементом?
Робота гальванічного елемента. Коли він перестає робити?
Що називається електричним струмом?
Як розраховують ЕРС (електрорушійна сила) гальванічного елементу?
Чи можна зробити гальванічний елемент з одного і того же металу?
Що таке концентраційний гальванічний елемент?
Схематична запис гальванічного елемента.
Що таке поляризація електрода. Коли вона відбувається?
Атомні батареї.
Сонячні батареї.
Тема: Електроліз
Що називається електролізом?
Що таке „катіони” і „аніони”?
Електроліз розплавів.
Електроліз розчинів.
Чому із розчинів при електролізі не виділяються метали, які знаходяться в ряду напруг до алюмінію, включно?
Чому із розчинів при електролізі не виділяються залишки кисневмісних кислот?
Закони Фарадея. Вихід по струму.
Що таке потенціал розкладення? Що таке перенапруга?
10. Явище хімічної і електрохімічної поляризації електродів.
11.Що таке гальванопластика і гальваностегія?
Тема: Акумулятори
Які прилади називаються акумуляторами?
Будова свинцевого акумулятора.
Що таке сухозарядженний акумулятор?
Будова залізо – нікелевого акумулятора.
Напишіть рівняння хімічних реакцій, які мають місце під час зарядження та розрядження свинцевого та залізо – нікелевого акумуляторів.
Яким струмом заряджають акумулятор?
Якою величиною струму заряджають акумулятор?
Як визначити, що акумулятор заряджений, або розряджений? До якої величини напруги ведуть розрядження акумулятора?
10. У що перетворюються катодні і анодні пластини при зарядженні свинцевого та залізо – нікелевого акумуляторів?
11. Що таке „кипіння” акумулятора. Коли воно відбувається?
12. Що така сульфатація пластин. Коли вона відбувається?
13. Чому у свинцевому акумуляторі негативних пластин на одну більше, чим негативних?
14. Від чого залежить ємність акумулятора?
15. Як визначити ємність акумулятора?
16. Що краще акумулятор „перезарядити”, чи недозарядити?
17. Як змінюється щільність електроліту при зарядці і розрядці акумулятора.
18. Яка щільність електроліту на півдні України?
19. Як краще підзаряджати акумулятор струмом малої величини, чи великим струмом?
20. Які переваги та недоліки свинцевого акумулятора у порівнянні з залізо – нікелевим?
21. Чому в електроліт залізо – нікелевого акумулятора добавляють гідроксид літія?
22. Що означає надпис на акумуляторі : 6 СТ – 55 А/ч.
. Які домішки в акумуляторній кислоті є особливо шкідливими?
. Якими якісними реакціями можна виявити наявність соляної і азотної кислот, іонів трьохвалентного заліза і солей важких металів.
25. Будова срібно – цинкового акумулятора.
26. Газові акумулятори.
Тема. Корозія металів та методи захисту від корозії
Що називається корозією?
Типи корозії.
Що таке хімічна корозія, яка вона буває?
Що таке електрохімічна корозія.
Атмосферна корозія.
Ґрунтова корозія.
Воднева корозія.
Біокорозія.
Корозія під дією блукаючих струмів.
10. Фактори які впливають на корозію.
11. Методи захисту металів від корозії.
12. Анодний і катодний захисти.
13. Протекторний захист.
14. Електрозахист від корозії.
15. Інгібітори та активатори корозії.
Тема: Загальні властивості металів
Які елементи періодичної системи можна віднести до металів
Чому розподіл елементів на металеві і неметалеві слід вважати умовним?
3. Назвіть, які метали в періодичній системі відносяться до сімейства?
4. Фізичні властивості металів.
Класифікація металів в техніці та хімії.
6. Одержання металів.
7. Хімічні властивості металів.
8. У якому вигляді найчастіше використовуються метали.Назвіть сплави, які мають найбільш поширене застосування.
Тема: Високомолекулярні сполуки
Що називається високомолекулярними сполуками?
Одержання полімерів.
Фізичні властивості полімерів.
Класифікація полімерів.
Природні високомолекулярні сполуки.
Штучні полімери.
Синтетичні полімери.
Елементополімери.
Застосування полімерів.
Література
Л. Г. Рейтер, О. М. Степаненко, , В. П. Басов Теоретичні розділи загальної хімії Київ, „Каравела” , 2003 р.
В. П. Басов, В. М. Родіонов, О. Г. Юрченко Хімія. Навчальний посібник.
Київ, „Каравела” , 2003 р.
А. Г. Кульман
Общая химия
Москва, „Колос” , 1979 г.
М. К. Стругацкий, Б. П. Надеинский
Общая химия
Москва, „Высшая школа”, 1962 г.
Н. Л. Глинка
Общая химия Ленінград „Химия” 1979 г.
Н. Л. Глинка
Задачи и упражнения по общей химии Москва, 1959 г.
Б. В. Некрасов
Основы общей химии
Москва, «Химия», 1967 г. А. Т. Пилипенко, В. Я. Починок и др.
Справочник по элементарной химии Київ, „Наукова думка”, 1985 р.
Эрден – Груз Т.
Химические источники энергии Москва, 1974.
Методичні вказівки кафедри 2006 р.
Зміст
Лекція 1. Будова атома…………………………………… 3
Лекція 2. Будова атома (продовження) ………………… 12
Лекція 3. Хімічний зв язок і будова молекул…………… 21
Лекція 4. Термохімія та термодинаміка …………………. 39 Лекція 5. Хімічна кінетика та рівновага ………………… Лекція 6. Розчини неелектролітів ………………………..
Лекція 7. Розчини неелектролітів (продовження) ……... 7
Лекція 8. Розчини електролітів. Електролітична дисоціація Дисоціація води. Гідроліз солей Лекція 9 Окисно – відновні реакції ………………….. Лекція . Електрохімія. Гальванічні елементи ……..
Лекція 1 . Електроліз і його застосування ……………
Лекція . Акумулятори…………………………………
Лекція . Корозія металів і методи захисту від корозії... Лекція 14. Загальні властивості металів ………………… 1 Лекція 15. Високомолекулярні сполуки ………………….
Основні питання з хімії на які дають відповідь лекції......... 1
Література ...............................................................................
| |||||
| |||||
| |||||
| |||||
|
Смотреть все комментарии (6)
Работы, похожие на Реферат: Основи хімії
Меню |
||||
| Главная Рефераты Благодарности |
||||
Опрос |
||||





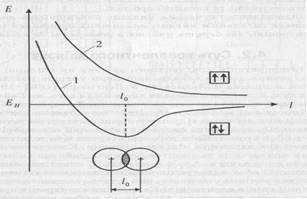

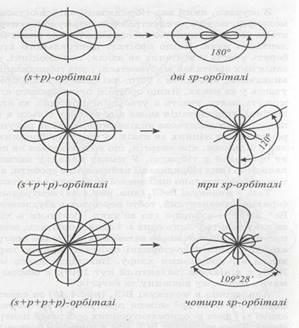
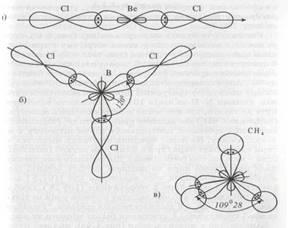
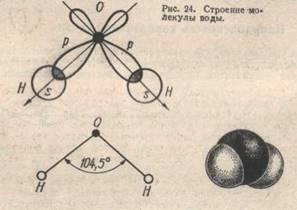
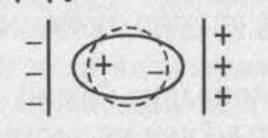
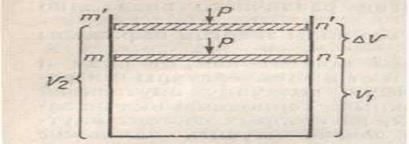
 Концентрація продуктів реакції буде збільшуватися до якогось часу, а потім почне зменшуватися.
Концентрація продуктів реакції буде збільшуватися до якогось часу, а потім почне зменшуватися.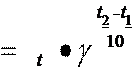 V
V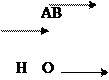 А В
А В