|
Реферат
Синтез и превращения азотпроизводных карбоновых кислот
Содержание
стр.
Введение 3
1. Амидирование 4
2. Дегидратация амидов и гидратация нитрилов 8
3. Гидролиз и этерификация нитрилов 11
Список литературы 15
Введение
Процессы гидролиза, гидратации, дегидратации, этерификации и амидирования имеют очень важное значение в промышленности основного органического и нефтехимического синтеза. Гидролизом жиров, целлюлозы и углеводов давно получют мыло, глицерин, этанол и другие ценные продукты. В области органического синтеза рассматриваемые процессы используют главным образом для производства спиртов C2
-C5
, фенолов, простых эфиров, 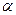 -оксидов, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов) и других соединений. -оксидов, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов) и других соединений.
Перечисленные вещества имеют очень важное применение в качестве промежуточных продуктов органического синтеза (спирты, кислоты и их производные, альдегиды, 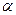 -оксиды), мономеров и исходных веществ для синтеза полимерных материалов (фенол, эфиры акриловой и метакриловой кислот, меламин, хлоролефины), пластификаторов и смазочных материалов (сложные эфиры), растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов (эфиры карбаминовой и тиокарбаминовой кислот). Очень часто рассматриваемые реакции являются промежуточным этапом в многостадийных синтезах других продуктов целевого назначения. -оксиды), мономеров и исходных веществ для синтеза полимерных материалов (фенол, эфиры акриловой и метакриловой кислот, меламин, хлоролефины), пластификаторов и смазочных материалов (сложные эфиры), растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов (эфиры карбаминовой и тиокарбаминовой кислот). Очень часто рассматриваемые реакции являются промежуточным этапом в многостадийных синтезах других продуктов целевого назначения.
Производство перечисленных веществ имеет большие масштабы. Так, в США синтезируют по 500 тыс. т этанола и изопропанола, 900 тыс. т пропиленоксида, 200 тыс. т эпихлоргидрина, свыше 4 млн. т сложных эфиров, около 300 тыс. т изоцианатов.
1. Амидирование
При действии аммиака, первичных или вторичных аминов на карбоновые кислоты получаются амиды кислот:
RCOOH + NH3
↔ RCONH2
+ H2
O
RCOOH + R’NH2
↔ RCONHR’ + H2
O
RCOOH + R’NH2
↔ RCONR’2
+ H2
O
Реакция во многом сходна с этерификацией. Она также обратима, но, по сравнению с этерификацией, ее равновесие сильнее смещено вправо. Строение кислоты оказывает такое же влияние на термодинамику и скорость амидирования, как при этерификации (разветвление и удлинение углеродной цепи кислоты повышает константу равновесия, но снижает скорость процесса). Аммиак и особенно амины являются более сильными нуклеофильными реагентами, чем спирты, поэтому амидирование может протекать в отсутствие катализаторов, путем нагревания реагентов при 200 – 3000
С в жидкой фазе. Удаление воды при использовании избытка аммиака (или амина) способствует достижению высокой степени конверсии. В отдельных случаях рекомендовано применять катализаторы кислотного типа, например AI2
O3
.
Карбоновая кислота и амин (или аммиак) образуют соль, но последняя не активна при амидировании, и ее образование ведет к дезактивированию обоих реагентов. Поэтому соль должна вначале продиссоциировать на свободную кислоту и амин, после чего протекает амидирование:
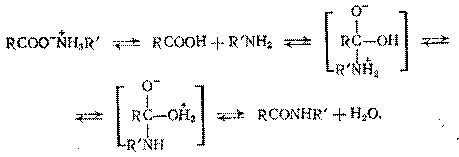
Скорость реакции пропорциональна концентрациям свободной кислоты и амина (аммиака), которые определяются равновесием диссоциации соли. Константа этого равновесия растет с повышением температуры, чем и обусловлен выбор температуры амидирования.
Амидирование, как и этерификацию, можно провести в очень мягких условиях действием хлорангидридов кислот:
RCOCI + R’NH2
→ RCONHR’ + HCI
Сложные эфиры также реагируют с аммиаком и аминами по обратимой реакции, равновесие которой сдвинуто вправо:
RCOOR’ + R”NH2
↔ RCONHR” + R’OH
Эта реакция протекает значительно быстрее, чем амидирование самих карбоновых кислот. Она осуществляется без катализаторов при 50 – 1000
С и является удобным методом синтеза некоторых амидов.
Процессы амидирования имеют важное значение в промышленности основного органического и нефтехимического синтеза для производства ряда ценных соединений. Из эфиров муравьиной кислоты, синтезируемых из оксида углерода и спиртов в присутствии основных катализаторов, получают диметилформамид:
CO + ROH  HCOOR HCOOR 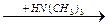 HCON(CH3
)2
+ ROH HCON(CH3
)2
+ ROH
Это – ценный растворитель, применяемый для абсорбции ацетилена из углеводородных газов, в производстве полиакрилонитрильного волокна и т. п.
Из уксусной кислоты и диметиламина получают растворитель диметилацетамид; стеариновая и другие высшие карбоновые кислоты дают с эталонаминами этаноламиды:
CH3
COOH + (CH3
)2
NH → CH3
CON(CH3
)2
+ H2
O
C17
H35
COOH + H2
NCH2
CH2
OH 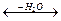 C17
H35
CONHCH2
CH2
OH C17
H35
CONHCH2
CH2
OH
Из уксуной кислоты и диметиламина получают растворитель диметилацетамид; стеариновая и другие высшие карбоновые кислоты дают с этаноламинами этаноламиды:
CH3
COOH + (CH3
)2
NH → CH3
CON(CH3
)2
+ H2
O
C17
H35
COOH + H2
NCH2
CH2
OH 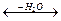 C17
H35
CONHCH2
CH2
OH C17
H35
CONHCH2
CH2
OH
Последние обладают хорошими пенообразующими свойствами и применяются как компоненты моющих и текстильно-вспомогательных средств.
К амидированию способны внутренние эфиры гидроксикарбоновых кисло (лактоны). Из 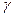 -бутиролактона и аммиака или метиламина получают -бутиролактона и аммиака или метиламина получают 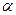 -пирролидон и N-метилпирролидон: -пирролидон и N-метилпирролидон:
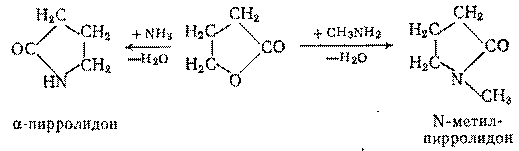
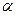 -Пирролидон применяют для получения ценного мономера – N-винилпирролидона, а N-метилпирролидон является превосходным растворителем и экстрагентом, например, для выделения ацетилена из углеводородных газов. -Пирролидон применяют для получения ценного мономера – N-винилпирролидона, а N-метилпирролидон является превосходным растворителем и экстрагентом, например, для выделения ацетилена из углеводородных газов.
На реакции амидирования основан синтез важного класса пестицидов – неполных амидов циануровой кислоты. Их получают из цианухлорида и низших первичных аминов, например из этиламина получают симазин:
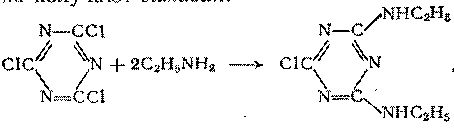
Пропильный гомолог симазина называется пропазином. Оба они, а также другие их аналоги, являются эффективными гербецидами.
При производстве амидов из карбоновых кислот или лактонов может быть несколько вариантов процесса.
1. Исходные реагенты и образующийся амид мало летучи (получение этаноламидов высших кислот и др.). В этом случае процесс ведут вначале при нагревании до 150 – 2000
С и завершают реакцию отгонкой воды (в вакууме, отдувкой азотом).
2. Наиболее летучим компонентом реакционной массы является один из исходных реагентов (обычно аммиак или амин, как в производстве лактамов из лактонов). Реакцию проводят при 200 – 3000
С с избытком аммиака или амина под давлением, необходимым для поддержания реакционной массы в жидком состоянии. При малой летучести кислоты и амида можно барботировать при атмосферном давлении аммиак, который одновременно выдувает образующуюся воду, способствуя высокой степени конверсии реагентов. Второй вариант обычно применяют и при производстве амидов из сложных эфиров, для чего требуется температура 50-1000
С. Так, диметилформамид можно получать при атмосферном или повышенном давлении, барботируя газообразные метилформиат и диметиламин через продукт реакции и совмещая химическую реакцию с отгонкой метанола.
В единичных случаях ведут синтез амидов и в газовой фазе. Например, диметилацетамид получаю, пропуская пары уксусной кислоты и диметиламина при 2500
С через реактор, заполненный оксидом алюминия.
2. Дегидратация амидов и гидратация нитрилов
Дегидратация амидов кислот до нитрилов является равновесным и сильноэндотермическим процессом:
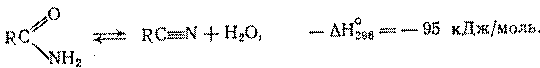
Равновесие смещается вправо только при 300 – 4000
С, причем для ускорения реакции требуются катализаторы кислотного типа (фосфорная кислота на носителе, оксид алюминия, алюмосиликаты, фосфаты). Механизм дегидратации состоит в такой же последовательности обратимых превращений:
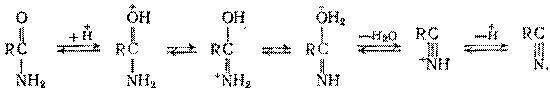
Таким путем нитрилы можно получать и непосредственно из карбоновых кислот (без промежуточного выделения амидов) в присутствии дегидратирующих катализаторов:
RCOOH +NH3
↔ RCN + 2H2
O,
но промышленное значение этот метод может иметь только в тех случаях, когда карбоновая кислота дешевле и доступнее, чем ее нитрил.
Адиподинитрил CN(CH2
)4
CN (динитрил адипиновой кислоты) является промежуточным продуктом при получении гексаметилендиамина из адипиновой кислоты:
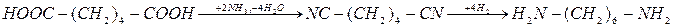
Адипинонитрил можно получать в жидкой и газовой фазе. При газофазном процессе в качестве катализатора применяют фосфорную кислоту на носителе. Сначала через расплавленную адипиновую кислоту, нагретую в испарителе до 2000
С, пропускают избыток аммиака. При этом происходит ступенчатое амидирование до моно- и диамида. Смесь паров этих веществ вместе с избыточным аммиаком поступает контактный аппарат адиабатического типа, заполненный катализатором. В нем при 390 – 3000
С и времени контакта 6 секунд завершается реакция амидирования и происходит дегидратация амида с образованием амидонитрила, адиподинитрила и побочного продукта - иминоцианоциклопентана:

После использования тепла горячей реакционной смеси ее охлаждают, причем адиподинитрил, амидонитрил, иминоцианоциклопентан и вода конденсируются, а несконденсированный аммиак возвращают на реакцию. Воду отделяют от органических продуктов в сепараторе. Водный слой содержит значительное количество растворенного адиподинитрила, который лучше всего экстрагировать толуолом или ксилолами. Адиподинитрил выделяют в чистом виде (выход 80%) вакуум-перегонкой.
Другие способы получения адиподинитрила – хлорирование бутадиена – 1,3 с замещением атомов хлора на цианогруппы и электрогидродимеризация акрилонитрила:
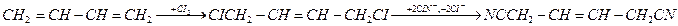
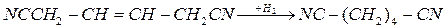
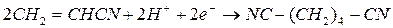
Все эти способы реализованы в промышленности. Кроме них разрабатывают методы, основанные на каталитическом присоединении HCN к бутадиену-1,3 и каталитической гидродимеризации акрилонитрила, но в этих случаях побочно образуется значительное количество изомерных динитрилов.
В противоположность дегидратации амидов, гидратация нитрилов в амиды кислот является экзотермической реакцией и при умеренных температурах практически необратимой. Наибольший интерес она представляет для синтеза акриламида из акрилонитрила:
CH2
=CHCN + H2
O → CH2
=CHCONH2
Ранее этот процесс осуществляли с 80-85% серной кислотой, что приводило к излишнему расходу реагентов и образованию отходов сульфата аммония. Позднее было обнаружено, что эффективным катализатором является металлическая медь. Синтез осуществляют в водном растворе при 70-1200
С; из реакционной массы отфильтровывают медь и отгоняют непревращенный акрилонитрил, рециркулируя их в реактор. Водный раствор акриламида упаривают до концентрации 30 – 50% или до получения кристаллического акриламида.
Акриламид легко полимеризуется в водорастворимый полиакриламид, который является ценным флокулянтом, широко применяемым для разделения водных суспензий, при флотации, очистке сточных вод и др.
3. Гидролиз и этерификация нитрилов
Гидролиз нитрилов является одним из распространенных методов синтеза карбоновых кислот. Это объясняется доступностью многих нитрилов, получаемых замещением хлора на цианогруппу, окислительным аммонолизом, цианогидрированием карбинольных соединений и т. д.
Гидролиз нитрилов протекает через промежуточное образование амидов и катализируется как кислотами, так и щелочами. Катализаторы связывают продукты реакции в соли, что обеспечивает необходимость гидролиза:
RCOONa + NH3
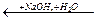 RCN RCN 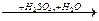 RCOOH + NH4
HSO4 RCOOH + NH4
HSO4
Обычно предпочитают кислотный гидролиз, позволяющий получить карбоновую кислоту в свободном виде. Он осуществляется в водной среде с не менее чем стехиометрическим количеством кислоты при 50-800
С и протекает через следующие стадии:
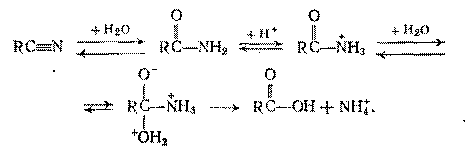
Реакция сильно экзотермична, поэтому ее проводят, постепенно приливая нитрил к нагретому раствору серной кислоты в охлаждаемом реакторе с мешалкой. Таким путем получают фенил-уксусную кислоту, малоновую и др. Так, если адиподинитрил получен из бутадиена-1,3 или акрилонитрила, его гидролизом можно синтезировать адипиновую кислоту:
NC-(CH2
)4
-CN + 4H2
O + 2H+
→ HOOC-(CH2
)4
-COOH + 2NH+
4
Если целевыми продуктами являются не сами кислоты, а их сложные эфиры, можно совместить гидролиз нитрила с этерификацией. В этом случае процесс ведут со смесью воды и спирта, причем серная кислота катализирует и гидролиз и этерификацию:
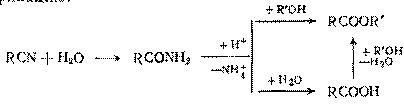
До недавнего времени это был самый экономичный способ синтеза эфиров акриловой кислотой из акрилонитрила:
CH2
=CHCN + H2
O + ROH + H+
→ CH2
=CH-COOR +NH+
4
,
Но теперь он вытесняется более эффективным путем этерификации акриловой кислоты, полученной окислением пропилена.
Еще раньше акриловую кислоту и ее эфиры вырабатывали из цианогидрина ацетальдегида. Аналогичный этому метод сохраняет значение для производства метакриловой кислоты и ее эфиров. Вначале из ацетона и синильной кислоты синтезируют ацетонцианогидрин:
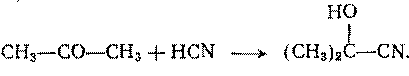
При обычном гидролизе последний дает 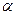 -гидроксиизомасляную кислоту (CH3
)2
C(OH)-COOH, но при обработке ацетонцианогидрина 100% серной кислотой происходит образование имида и затем его дегидратация с образованием ненасыщенного амида. При добавлении воды и метанола происходит этерификация; серная кислота служит катализатором: -гидроксиизомасляную кислоту (CH3
)2
C(OH)-COOH, но при обработке ацетонцианогидрина 100% серной кислотой происходит образование имида и затем его дегидратация с образованием ненасыщенного амида. При добавлении воды и метанола происходит этерификация; серная кислота служит катализатором:
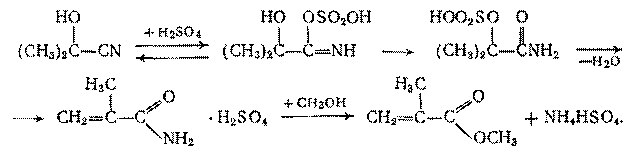
Побочно образуются диметиловый эфир (за счет межмолекулярной дегидратации спирта), эфир  -гидроксиизомасляной кислоты, немного смол и полимеров. -гидроксиизомасляной кислоты, немного смол и полимеров.
Общим недостатком рассматриваемых методов является большой расход серной кислоты, которую приходится утилизировать в виде малоценного удобрения (сульфат аммония). Получается также значительное количество токсичных сточных вод.
Производство метилметакрилата пока осуществляют описанным способом из ацетонцианогидрина. Технологическая схема способа представлена на рис. 1.
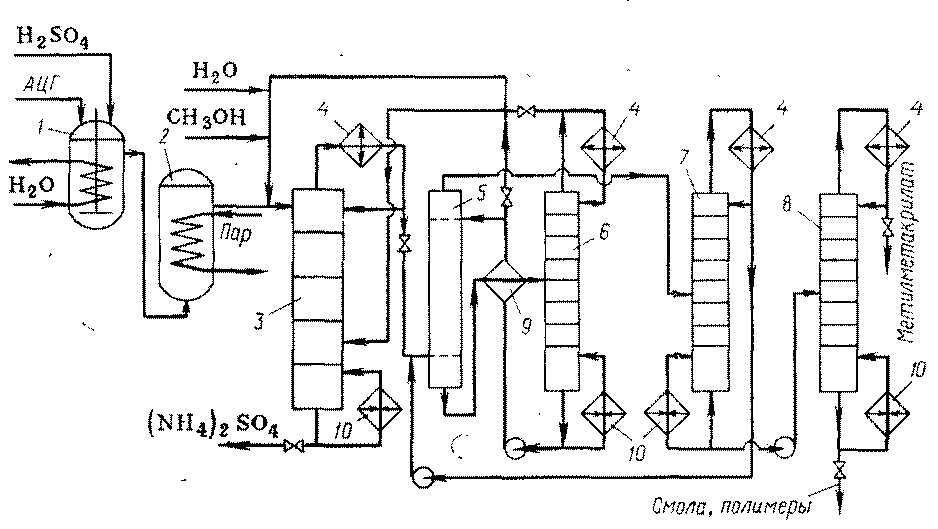
Рис. 1 Технологическая схема получения метилметакрилата из ацетонцианогидрина
1. Смеситель, 2. Реактор, 3. Эфиризатор, 4. Конденсаторы-дефлегматоры, 5. Экстрактор, 6. Отпарная колонна, 7,8. Ректификационные колонны, 9. Теплообменник, 10. Кипятильники
Ацетонцианггидрин (АЦГ) и 100% серную кислоту (моногидрат) в мольном соотношении 1,0 : 1,5 непрерывно подают в смеситель 1, где образуется имид. При смешении выделяется большое количество тепла, поэтому смеситель снабжен мешалкой и змеевиком для охлаждения, способными обеспечить температуру 80-850
С. Реакционная смесь перетекает через боковой перелив в реактор 2, где за счет обогрева паром достигается температура 130 – 1350
С. При этих условиях имид превращается в сульфат метакриламида.
Полученную реакционную массу смешивают с некоторым количеством воды и частью метанола и направляют в Эфиризатор 3 уже встречавшегося ранее типа тарельчатой колонны. Она имеет кипятильник, при помощи которого азеотропную смесь метиметакрилата с водой и метанол отгоняют от раствора сульфата аммония, который выводят из куба. Из-за высокой летучести вводят часть метанола на одну из нижних тарелок эфиризатора, чтобы обеспечить его наличие на всех тарелках. Пары азеотропной смеси и метанола конденсируются в конденсаторе-дефлегматоре 4, причем часть конденсата возвращают в эфиризатор 3 в качестве флегмы, а остальное отводят на переработку.
Первый этап переработки – промывка конденсата подщелоченной водой в экстракторе 5, где из органического слоя отмываются метанол и примеси кислотного характера можно использовать для разбавления сульфата метакриламида перед эфиризатором 3, а от остального количества в отпарной колонне 6 отгоняют метанол и растворенный в экстракте метилметакрилат, который возвращают на реакцию. Органический слой с верха экстрактора 5 поступает в ректификационную колонну 7, где отгоняют азеотропную смесь метилметакрилата с водой, возвращаемую на экстракцию. Кубовая жидкость поступает в колонну 8; верхним продуктом является чистый метилметакрилат, а в кубе остаются смолы и полимеры, направляемые на сжигание. Чтобы избежать полимеризации метилметакрилата, на стадиях этерификации и разделения добавляют ингибитор (гидрохинон).
Список литературы
1. Габриэлян О. С., Остроумов И. Г. Химия. М., Дрофа, 2008;
2. Чичибабин А. Е. Основные начала органической химии. М., Госхимиздат, 1963. – 922 с.;
3. Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. М., Химия. 1988. – 592 с.;
4. Паушкин Я. М., Адельсон С. В., Вишнякова Т. П. Технология нефтехимического синтеза. М., 1973. – 448 с.;
5. Юкельсон И. И. Технология основного органического синтеза. М., «Химия», 1968.
|