| ГОУ гимназия №1505
«Московская городская педагогическая гимназия-лаборатория»
«Московский Городской Педагогический университет; биолого-химический университет»
РЕФЕРАТ
R
,
R
-винная кислота
и её производные
Выполнил
Ученик 10А класса
Алексеенок Тимофей
Руководитель
к.х.н., доцент кафедры «Органическая химия МГПУ»
Ройтерштейн Дмитрий Михайлович
Москва, 2009.
Содержание:
Введение___________________________________________________
3
Винная кислота_____________________________________________
3
Оптическая изомерия________________________________________
4
Поляриметр_________________________________________________
6
L
-винная кислота____________________________________________
7
Описание опыта_____________________________________________
8
Получение бензалиден-диэтилтартрата________________________8
Щелочной гидролиз бензилиден-диэтилтартрата________________9
Получение 2-фенил-1,3-диоксолан-4,5(RR)-диэтилкарбоксилата лантана
и иттербия___________________________________________________10
Заключение________________________________________________
11
Приложения____________________________________________________
12
1.ЯМР спектр R,R-2-фенил-1,3 диоксолан-4,5
диэтилкарбоксилата______________________________________12
2.ЯМР спектр R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата
лантана_________________________________________________13
3.ЯМР спектр R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата
иттербия___________________________________________________ 14
Список литературы
_________________________________________14
Введение.
Цель данного реферата описать свойства RR-винной кислоты и её производных, которые могут выступать в качестве лигандов различных металлов.
Задачи данной работы:
1.Исследовать литературу по теме R,R-винная кислота и её изомеры, пополнить свои познания в этой теме.
2.Составить чёткое представление о хиральных органических соединениях, их изомерии и номенклатуре.
3.Создать текст рассчитанный на непросвещённого читателя.
4.Получить опыт работы с новым оборудованием недоступного в средней школе.
5.Получить производные винной кислоты –
2-фенил-1,3-диоксолан-4,5-дикарбоновую кислоту и её комплексы с иттербием и лантаном.
Винная кислота.
Винная кислота (диоксиянтарная) это двухосновная карбоновая оксикислота. Она содержится в чистом виде в соке винограда и в виде солей (тартраты и гидротартраты) в картофеле, огурцах и чёрном перце. Винная кислота используется в пищевой промышленности как консервант и в красильной промышленности как красный пигмент. Винная кислота представляет собой большие, прозрачные призмы с температурой плавления 170о
С. Обладает сильным, но приятным кислым вкусом, легко растворима в воде и спирте, трудно в эфире. Её формула С4
Н6
О6
. Винная кислота диссоциирует и реагирует с основаниями, с оксидами, с солями как и все органические кислоты. Как и многие органические вещества, винная кислота существует в виде нескольких изомеров.
“Изомеры-соединения, которые имеют одинаковые молекулярную формулу, но разное расположение атомов. Среди различных типов изомеров можно выделить два главных: структурные изомеры и стереоизомеры. Структурные изомеры имеют одинаковые молекулярную формулу, но их атомы связаны в разных последовательностях. Стереоизомеры имеют одинаковую молекулярную формулу и одинаковую последовательность связывания атомов, но отличаются пространственным расположением атомов. Стереоизомеры подразделяются на две категории: геометрические и оптические изомеры. Все изомеры обладают различными химическими и/или физическими свойствами ”. [1,с.341] L-винная кислота является оптическим изомером винной кислоты.
Оптическая изомерия.
Если в органическом соединении к атому углерода присоединены четыре разных атома, то такой атом называется асимметрическим или хиральным. Молекулы с асимметрическими атомами углерода нельзя совместить с их зеркальными отображениями. Поэтому две молекулы, которые являются зеркальными отображениями друг друга, представляют собой изомеры. Они называются энантиомерами. Энантиомеры могут существовать отдельно или в смеси. Смесь, содержащая равное количество энантиомеров, называется рацемической смесью. Кристаллы двух энантиомеров являются зеркальным отображением друг друга. Энантиомеры различаются только по оптической активности, все остальные свойства у них одинаковы.
Оптически активными называются соединения, которые могут вращать плоскость прохождения световых колебаний. Луч света представляет собой поток электромагнитных волн, колебания которых происходит по всем направлениям под прямым углом к направлению распространения луча света. Свет, колебания которого происходят в одной плоскости, называется плоскополяризованным.
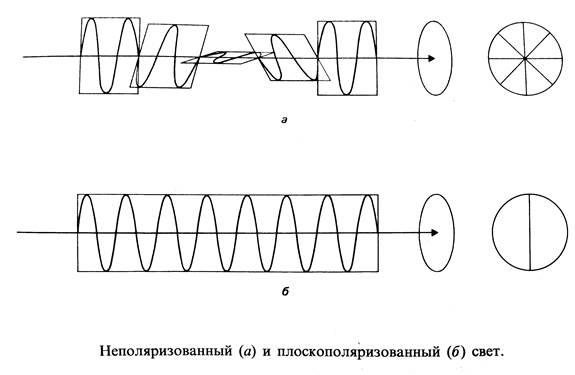
Если соединение состоит из асимметрических молекул, то оно оптически активно. Рацемическая смесь (рацемат) – эквимолярная смесь двух энантиомеров, оптически неактивна. Все соединения, содержащие хиральный атом углерода, проявляют оптическую активность. Все энантиомеры оптически активны, поэтому их называют оптическими изомерами. Если один энантиомер вращает плоскость поляризации света по часовой стрелке, то другой энантиомер обязательно будет вращать плоскость против часовой стрелки.
У винной кислоты два хиральных центра, поэтому у неё должны быть четыре стереоизомера, но эти хиральные центры одинаковы. Соответственно может существовать только три комбинации: RR (L-винная кислота), SS (D-винная кислота), SR или RS (мезовинная кислота). L-винная, D-винная и мезовинная кислоты. Эти стереоизомеры отличаются пространственным строением.
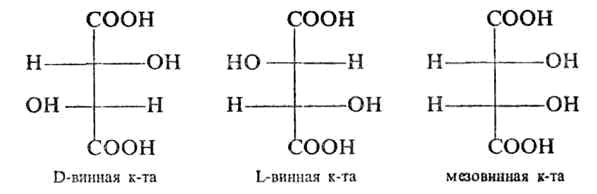
L-винная кислота является зеркальным отображением D-винной кислоты. L-винная и D-винная кислоты не отличаются химическими и физическими свойствами. Мезовинная кислота отличается от L-винной и D-винной кислот и химическими и физическими свойствами.
L-винную и D-винную кислоты можно различить, измерив угол оптического вращения плоскополяризованного света, пропущенного через образец с кислотой, с помощью специального прибора – поляриметра.
Поляриметр.
Для измерения угла вращения плоскости поляризованного света каким-либо энантиомером используется специальный прибор – поляриметр. В этом приборе используется монохроматический источник света, например натриевая лампа. Монохроматический свет характеризуется одной длиной волны, тогда как обычный белый свет представляет собой смесь с разными длинами волн в пределах видимого диапазона.
Монохроматический свет не поляризован. Поэтому его пропускают через поляризатор, который превращает его в плоскополяризованный свет. Затем плоскополяризованный свет пропускают через кювету с раствором того вещества, для которого производится измерение угла оптического вращения. Свет, выходящий из кюветы с образцом, имеет плоскость поляризации, повёрнутую по часовой стрелке или против часовой стрелки на некоторый угол, который и подлежит измерению. “Направление вращения определяется по отношению к наблюдателю, а угол вращения определяется с помощью специального анализатора, который имеется в поляриметре.
Анализатор представляет собой устройство, которое пропускает только плоскополяризованный свет. Сначала он устанавливается так, чтобы пропускать плоскополяризованный свет, вышедший из поляризатора, но не повёрнутый образцом. Плоскополяризованный свет, повёрнутый образцом, не может пройти сквозь анализатор, который находится в исходном положении. Тогда анализатор поворачивают до тех пор, пока он не станет максимально пропускать свет, прошедший через кювету с образцом. В таком положении плоскость пропускания анализатора совпадает с плоскостью света, прошедшего сквозь образец. Разность углов между исходным и окончательным положениями анализатора определяет угол оптического
вращения исследуемого вещества”. [1,c.346] 
L-
винная кислота.
L-винная кислота получается из виноградного сока при его брожении. Она выделяется в виде нерастворимой калиевой соли C4
H5
O6
K, по-другому называемой винным камнем. Этот камень использовался в древности греками и римлянами для получения виноградного вина. L-винная кислота широко производится во всём мире и используется в медицине, пищевой промышленности, в аналитической химии и в органическом синтезе. Её соли имеют широкое применение в пищевой промышленности (соль аммония С4
Н4
О6
(NH4
)2
разрыхлитель теста, соль натрия (гидротартрат) С4
Н5
О6
Nа·Н2
О используется в производстве шипучих напитков), в пиротехнике (соль бария С4
Н4
О6
Ва окрашивает пламя в зелёный цвет, соль стронция С4
Н4
О6
Sr окрашивает пламя в красный цвет), в электролизе (С4
Н4
О6
Са компонент ванн для электролитической полировки меди).
Описание опыта.
Задача: получить комплексы с
R
,
R
-
2-фенил-1,3-диоксолан-4,5-диэтилкарбоксилатным лигандом.
Цель: исследовать свойства
R
,
R
-винной кислоты.
1. Получение бензилиден-диэтилтартрата (
R
,
R
-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата).
Взяли 100 мл (83,95 г; 0,5 моль) бензальдегида и перегнали в вакууме. Перегнанный бензальдегид слили в круглодонную колбу, снабжённую магнитной мешалкой и обратным холодильником, и добавили диэтиловый эфир RR-винной кислоты (m=103 г, 0,5 моль, ρ=1,205г/см3
) и 430 мл толуола. Смесь кипятили и перемешивали одну неделю. При этом выделилось 12 мл воды (mтеор
=9 мл, 3 мл – вода, содержавшаяся в толуоле).

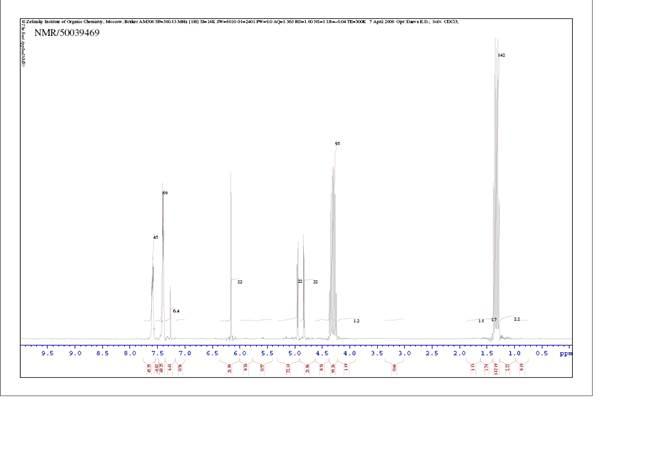
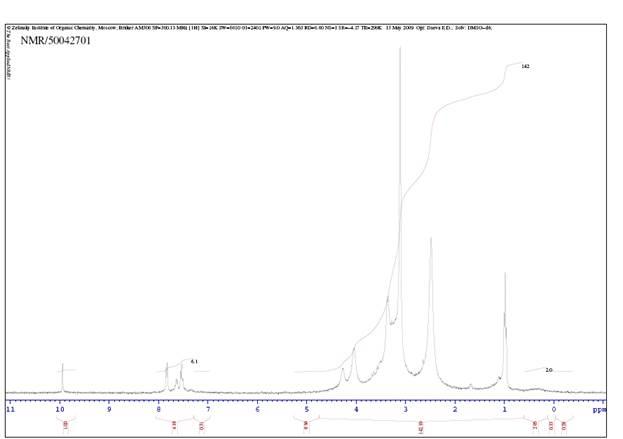
В делительную воронку на один литр добавили 200 мл бикарбоната натрия и полученный при кипячении R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилат. Смесь промыли водой (2х200 мл), насыщенным раствором хлоридом натрия (100 мл), диэтиловым эфиром (100 мл) и высушили сульфатом натрия. Вещество (m=83,39 г) упарили при пониженном давлении. После выпаривания добавили 100 мл гексана. Оставили на неделю, чтобы он закристаллизовался и отфильтровали полученный кристалл и сняли ЯМР спектр (см. приложение 1) Отфильтровали RR-2-фенил-1,3-диоксолан-4,5-диэтилкарбоксилат (m =47,76г).
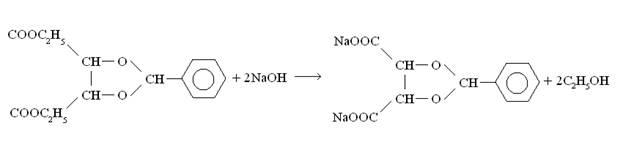
2. Щелочной гидролиз бензилиден-диэтилтартрата (
R
,
R
-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата).
Взяли 47,76 г (0,1 моль) R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата, добавили этиловый спирт (70 мл); перемешивали и порциями добавляли гидроксид натрия (14 г, 0,35 моль), растворённый в 30 мл воды. Кипятили в круглодонной колбе с магнитной мешалкой и холодильником, в ходе кипячения добавили 50 мл этанола. Чтобы убедиться, что реакция прошла, взяли 1 мл полученного вещества, упарили и сняли ЯМР спектр, который показал, что реакция завершилась.
Смесь упарили вдвое в вакууме, отогнав спирт (115 мл). Вещество промыли эфиром (3х50 мл) и к остатку добавили соляную кислоту для получения кислой среды (рН=1). 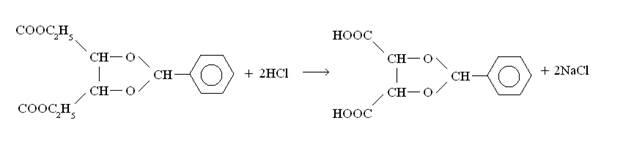 Экстрагировали 50 мл диэтилового эфира. Промыли петролейным эфиром (3х50 мл), упарили в вакууме. Вещество растёрли в петролейном эфире и профильтровали. Экстрагировали 50 мл диэтилового эфира. Промыли петролейным эфиром (3х50 мл), упарили в вакууме. Вещество растёрли в петролейном эфире и профильтровали.
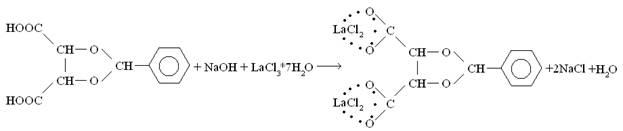
3. Получение 2-фенил-1,3-диоксолан-4,5(
RR
)-диэтилкарбоксилата лантана и иттербия.
Взяли 0,2 г (0,00084 моль) полученной кислоты, добавили 8 мл метанола,
1,68 мл (0,00168 моль) щёлочи и 0,624 г (0,00168 моль) хлорида лантана.
Смесь упарили досуха и добавили 7 мл метанола. Прилили 4 мл эфира поверх смеси, чтобы образовался слой для медленного и качественного смешивания. Оставили на неделю.
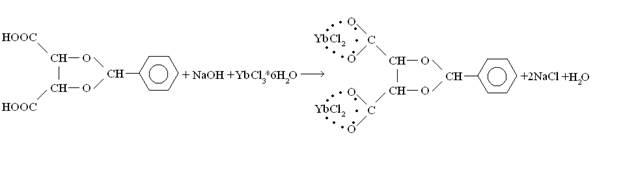
Взяли 0,2 г (0,00084 моль) полученной кислоты, добавили 8 мл метанола,
1,68 мл (0,00168 моль) щёлочи и 0,651 г (0,00168 моль) хлорида иттербия.
Выпавший осадок упарили досуха и добавили 3 мл метанола. Прилили 5 мл эфира поверх смеси. Оставили на неделю.
Выпавшие осадки отфильтровали, высушили, взвесили, измерили температуру плавления и сняли ЯМР спектр.
Комплекс с La: порошок песочного цвета, m=0,237 г, tразложения
выше 280о
С, t начала плавления
=260o
С, t конца плавления
=280o
С. При 280o
С порошок приобрёл тёмно-зелёный цвет.
Комплекс с Yb: порошок белого цвета m=0,225 tначала плавления
=342o
С, t окончания
плавления
367о
С, потемнел при t=350о
С, tразложения
выше 367о
С.
Вывод: были получены два комплекса с иттербием и лантаном.
Заключение.
В итоге был написан реферат, посвящённый теме RR-винная кислота и её производные. В процессе написания был приобретён навык работы с научной литературой и новым оборудованием. Были получены два комплекса с иттербием и лантаном на основе R,R-винной кислоты. Итак, RR-винная кислота и её производные являются доступными, дешёвыми и оптически активными реагентами.
Приложения.
1.ЯМР спектр R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата.
2. ЯМР спектр R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата лантана.
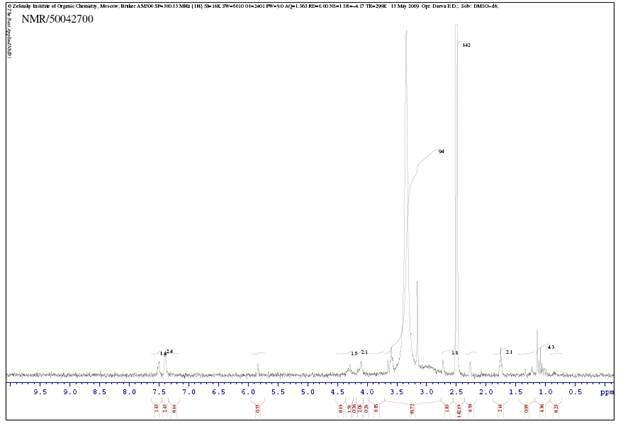
3.ЯМР спектр R,R-2-фенил-1,3 диоксолан-4,5 диэтилкарбоксилата иттербия.
Литература:
1. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. – М.: Химия, 1979.
2. Терней А. Органическая химия. – М.: Мир, 1981.
3. Фримантл М. Химия в действии. – М.: Мир, 1991.
|