Производство соли. Йодированная поваренная соль
Употребление йодированной поваренной соли, содержащей примесь KI, предупреждает болезнь щитовидной железы — зобную эндемию, развивающуюся при недостатке иода в питьевой воде. Ежедневная потребность человека в иоде составляет 0,06 — 0,1 мг.
С течением времени иодид калия окисляется с выделением быстро улетучивающегося иода. Разложение KI значительно ускоряется в присутствии влаги и в особенности окислителей. Имеются попытки применения йодата калия, который в присутствии некоторых йодорганических соединений не разлагается в течение длительного времени.
Добавка в соль различных веществ, так называемых стабилизаторов — фосфатов и карбонатов кальция или магния и других — увеличивает стойкость иодированной соли. Лучшим стабилизатором оказался тиосульфат натрия, восстанавливающий элементарный иод до Nal. Введение тиосульфата натрия в количестве 1% от KI или 0,00001% от веса соли позволяет хранить иодированную соль в течение шести месяцев без потерь иода. Без стабилизатора KI полностью исчезает в течение 2—3 месяцев. Для предупреждения потерь иода при хранении иодированной соли предложено также добавлять к ней активированный уголь.
Иодированную соль приготовляют мокрым и сухим способами. Мокрый способ заключается в опрыскивании соли раствором KI, содержащим тиосульфат натрия, из форсунок или капельниц. Концентрация раствора KI должна быть такой, чтобы влажность соли не возрастала более чем на 1%- Обычно применяют раствор, содержащий 2,5—5 г/л KI. Для увеличения сроке хранения иодированной соли предложено иодировать ее опрыскиванием водным раствором иодинола (1 г/л 12 и 3 г/л KI), приготовляемого из поливинилового спирта и раствора иода в иодиде калия.
Иодирование производят на разных стадиях производства соли. Например, каменную и озерную соль удобно иодировать перед ее помолом (рис. 1). В процессе дальнейшего измельчения соли достигается равномерное распределение иодида калия в продукте. Иодирование выварочной соли мокрым способом может быть осуществлено перед сушкой в сушильных барабанах, а также в элеваторах или на транспортерах.
Попытка плавить иодированную соль для получения кусковой иодированной соли показала, что при этом теряется значительное количество иодида калияИ6. Для получения крупнокристаллической иодированной соли рекомендуют прибавлять KI к соляному рассолу до бассейной кристаллизации из него NaCl.
Сухой способ иодирования соли 88- 149 заключается в смешивании сухой соли с концентратом иодида калия, представляющим собой поваренную соль, содержащую в 100 раз больше стабилизированного KI, чем предусмотрено нормой, т. е. 1 г на 1000 г соли. Необходимость предварительного приготовления концентрата обусловлена невозможностью равномерного смешения твердых веществ в соотношении 1 : 100 000. Влажность концентрата должна быть не больше 0,1%- Для смешения концентрата с солью применяют шнековые и барабанные смесители. Более совершенными являются смесители центробежного и каскадного типов.
На заводе фирмы Canadian Salt Со. недавно стали использовать вибрационные питатели непрерывного действия с весами, для введения в соль (со скоростью 10— 750 г/мин) малых количеств CaI04, СоС03 и KI в смеси с алюмосиликатами (снижающими клейкость добавок). Эти питатели, как сообщают 1В1, позволяют отказаться от предварительного смешения.
Сухой способ иодирования соли одно время применялся более широко, чем мокрый способ, так как сухая иодированная соль более устойчива, чем влажная. Считают, однако, что после разработки метода стабилизации влажной иодированной соли целесообразнее применять мокрый способ иодирования, отличающийся большей простотой.
Получение соли вымораживанием
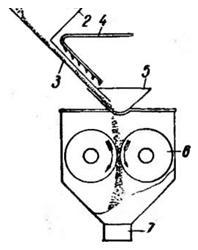
Рис. 1. Схема получения иодированной соли: 1—ленточный транспортер; 2—бункер крупнокристаллической соли; 3 — наклонный желоб; 4 — подвод раствора йодистого калия с ниппелями для опрыскивания соли: Я —горловина вальцового станка; 6 — вальцы; 7 —выход молотой и иодированной соли.
Добыча соли из концентрированных рассолов возможна путем кристаллизации соли при охлаждении рапы. Зимой, при низких температурах, из насыщенных рассолов вымерзает дигидрат хлористого натрия NaCl-2H20. Кристаллизация его идет тем интенсивнее, чем ниже температура, вплоть до температуры выделения криогидрата (—21,2°). Если дигидрат извлечь из рапы, то при повышении температуры воздуха выше +0,16° происходит его разложение и переход в чистую поваренную соль.
Дигидрат хлористого натрия выделяется в зимнее время в соляных источниках Якутской АССР, а также во многих других озерах. Выделяющийся дигидрат не содержит примесей, и его вымораживание из рассола является одним из методов получения чистой соли. При плавлении 1 т NaCl • 2Н20 при 25° можно получить 481,5 кг безводного хлористого натрия с выходом NaCl, равным 77,8% 1Б3.
Вымораживание соли зимой может производиться в таких же бассейнах, как и садка соли летом. Максимальный выход безводной соли из насыщенного рассола достигает 20% от начального содержания ее в исходном рассоле.
Однако получение поваренной соли вымораживанием является весьма сложным, громоздким процессом, требующим больших площадей бассейнов. При наличии дешевой электроэнергии метод искусственного вымораживания может оказаться выгодным для получения пищевой соли сорта экстра. Более эффективным является концентрирование морской воды в условиях холодного климата вымораживанием льда.
Степень выделения льда в зависимости от температуры охлаждения показана на рис. 15 82. Охлаждением морской воды до —17° с последующим отделением льда можно получить рассол, содержащий 9—12% солей ,54'155 (по другим данным 156 19%). Такой рассол после очистки от CaS04 пригоден для выделения NaCl методом выпарива- . ния. Из 1 мъ морской воды получается 30—32 кг соли 157. Качество втой соли различно: лучшие сорта могут содержать до 97—99% NaCl, а худшие 80—82%. В среднем она содержит ~ 10% примесей.
Непосредственная заводская выпарка морской воды требует много различного оборудования, т. е. больших капитальных вложений и значительного расхода топлива. Для получения из морской воды, содержащей 3,5% солей (из которых 80% NaCl), 1 7 поваренной соли нужно выпарить ~ 45 т воды. Для этого необходимо израсходовать при использовании четырехкорпусной вакуум-выпарной батареи 3 т, а при чренной выпарке 7 т условного топлива. С увеличением концентрации рассола количество выпариваемой воды на 1 т соли резко уменьшается; так при концентрации рассола 8% нужно выпарить 15 т воды, а при 12% только 9 т. Поэтому предварительное вымораживание льда из морской воды с последующей выпаркой оставшегося рассола экономически более выгодно.
Плотность пресной воды максимальна при +3,95°, максимум же плотности морской воды наблюдается при более низких температурах. При концентрации суммы солей 2,47% температура начала выделения льда (—1,332°) становится равной температуре максимальной плотности такого рассола (рис. 16). Более соленые воды (океана, соляных озер) замерзают при температурах выше температур их максимальной плотности. Например, океанская вода, соленость которой равна 3,5%, вамерзает при —1,91°, а максимальная плотность ее при —3,52°.
Эти свойства соленых вод имеют важное значение как для биологических, так и для галургических процессов. В то время как при замерзании поверхности пресного водоема подледная вода сохраняет температуру около +4° ввиду ее повышенной плотности, образование льда на поверхности соленых вод сопровождается конвекцией подледных рассолов из-за разности их плотностей, пока плотность не достигает максимума, для воды океана при —3,52°. Это может оказаться гибельным для некоторых видов фауны и флоры, но весьма благоприятно для галургических процессов, так как циркуляция подледных рассолов и низкая температура их максимальной плотности ускоряет охлаждение. Это приводит к увеличению степени вымораживания льда, укреплению рассолов и к повышению выхода солей, кристаллизующихся при понижении температуры. В бассейнах для зимней садки солей температура рассолов уже через несколько суток достигает средней температуры воздуха.
С увеличением концентрации растворов эти линии сближаются, так как растворимость сульфата кальция уменьшается. В растворах, насыщенных хлористым натрием, растворимость сульфата кальция столь мала, что кривые сливаются.
Как видно из диаграммы, на которой линия АВ{АВ')—путь кристаллизации льда, а линия ВС (В'С) — мирабилита, вымерзание льда из морской воды начинается при —1,8°. При —7,3° вместе со льдом кристаллизуется мирабилит Na2S04- ЮН20,
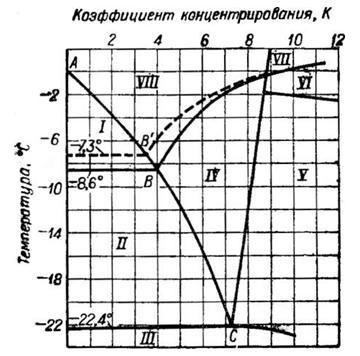
Рис. 2. Диаграмма глубокого охлаждения в зависимости от температуры вымерзания льда из морской воды
а при —15° начинает выделяться сульфат кальция. При —22,4° к этим твердым фазам присоединяется NaCl-2H20. Если при —22,4° отделить жидкую фазу от твердой и продолжать ее охлаждать, то при —34° раствор станет насыщенным хлоридом кальция. Таким образом, по мере понижения температуры раствор обогащается хлоридами магния и кальция, кристаллогидраты которых выделяются в осадок при еще более глубоком охлаждении. Конечный рассол замерзает при температуре около —60°.
лед может одержать разное /v-NasE04. гон20;количество твердых солевых Кае; примесей, т. е. иметь различобласть ненасыщенных растворов.ную «СОЛвНОСТЬ». До температуры —7° образуется достаточно чистый лед, а ниже этой температуры он все больше загрязняется примесями. По разным источникам соленость морского льда характеризуется величинами от 0,3 до 1%.
Из 1 т морской воды при охлаждении до начала кристаллизации мирабилита (—7,3°) вымерзает ~720 кг льда. При охлаждении до —16° выделяется в твердые фазы 80—85% сульфат-иона и получается —175 кг рассола. При вымораживании до —36е из 1 т морской воды остается всего ~26 кг рассола.
В Японии и других странах концентрирование морской воды осуществляют непосредственным вымораживанием льда1В0. Концентрировать морскую воду вымораживанием льда можно, раз- брыагивая ее при 0° в вертикальной башне, через которую циркулирует минеральное масло, с температурой —10°, В нижней части башни накапливается рапа плотностью 1,184 г/смъ, а вверху над маслом — лед.
Заслуживает внимания получение поваренной соли из морской воды комбинированием испарения и охлаждения с одновременным выделением мирабилита. Морскую воду (/, /°) или ее концентраты (/, /' или 1, /"), полученные вымораживанием или другим методом, выпаривают при 100° вначале до насыщения (/, I"'), а затем с кристаллизацией NaCl (/—2). Остающийся маточный раствор (2, 2') после отделения NaCl разбавляют водой (2,2") и охлаждают до —10°, причем кристаллизуется мирабилит (2—<9). Маточный раствор после отделения мирабилита (3, 3') выпаривают вторично при 100° для дополнительной кристаллизации NaCl (3—4). Конечный раствор состава 4, 4' остается в небольшом количестве и может быть использован для извлечения магниевых солей.
Важной проблемой человечества является расширение ресурсов пресной воды, запасы которой на земном шаре весьма ограничены. В связи с этим интенсивно разрабатываются различные методы опреснения соленых вод Помимо пресной воды при обессоливании морской воды и других соленых вод получаются1 более концентрированные рассолы, чем исходные. Они могут служить источниками выделения NaCl рассмотренными выше способами.
Опреснение морской воды в крупных масштабах производят различными путями. Широко применяют дистилляцию в вакуум- испарителях 162 и вымораживание льда 1В7-159,163-168. Применяют различные источники холода, в чаетности, вымораживание льда^ ведут за счет испарения небольшой части воды (0.5%) под вакуумом (абсолютное давление в вакуум-аппарате 3 мм рт. ст.) или за счет испарения под атмосферным давлением примешиваемых к соде легкокипящих веществ, например: бутана, изобутана 1б6, пропана, фреонов и др.168. Кристаллизующийся лед можно отделять •от остающейся воды фильтрованием, центрифугированием или флотацией 168. Все шире распространяется обессоливание электродиализом 161 и фильтрованием под давлением через мембраны, проницаемые для воды и почти не пропускающие растворенные в ней соли. Мембраной служит, например, пленка из ацетатной целлюлозы с модифицирующими добавками (перхлорат магния, ацетон). Используют и ионообменные смолы 17°т.
Получение поваренной соли высаливанием и перекристаллизацией
Уделялось много внимания разработке новых способов получения поваренной соли из рассолов путем высаливания ее хлористым магнием (рис. 19) или хлористым кальцием. Преимущества этих способов состоят в относительной простоте технологического процесса (заключающегося в смешении рассолов, отделении выпавших кристаллов соли и сушке их), в отсутствие расхода топлива на выпаривание рассола, в отсутствие необходимости предварительной очистки рассола и др.
При смешении, например, 1 м3 рассола, содержащего 20,7% NaCl, 1,3% MgS04, 4,3% MgCl2, 73,7% Н20 (плотность 1,23 г/см3) с 1 м3 хлор- магниевого рассола, со.- держащего 27,6% MgCl2, 4,4% MgS04, 1% NaCl, 67,0% Н20 (плотность 1,25 г/см3), выход кристаллизующейся поваренной соли составляет около 78 кг.
Разработаны способы перекристаллизации каменной соли, позволяющие получать чистую соль более дешевым путем, чем вакуум-выпаркой. Например, каменную соль смешивают с маточным раствором, остающимся после вторичной кристаллизации. Солевую пульпу перемешивают острым паром, конденсация которого приводит к растворению кристаллов соли при 100—105°. Нерас-
творившаяся часть, содержащая примеси (ангидрит и др.), отделяется в отстойнике, а горячий раствор направляют на кристаллизацию в две стадии — при охлаждении его до 80°, затем до 50е. Соль из кристаллизаторов отжимают на центрифугах и высушивают.
Другой способ заключается в обработке каменной соли циркулирующим насыщенным раствором NaCl при температуре от 0 до —20°; при этом соль переходит в дигидрат, который отфильтровывают и нагревают. Дигидрат плавится и выделяется чистая соль; рассол возвращают в процесс 174.
Из каменной соли, сильно загрязненной ангидритом, можно получить поваренную соль сорта «экстра» перекристаллизацией из растворов хлорида кальция. Каменную соль перемешивают в течение 30 мин с исходным раствором, содержащим 24% СаС1г- В кристаллизаторе раствор охлаждается от 112 до 20°. Выход NaCl из 1 м3 раствора около 50 кг. Получаемая после промывки соль содержит 99,2% NaCl. Расход СаС12 (100%) при 50-кратном использовании составляет 11 кг на 1 т получаемой соли .
Получение поваренной соли из галитовых отходов калийных предприятий
При переработке сильвинита на хлорид калия (стр. 154) в качестве отхода (отвала) получается загрязненный примесями хлорид натрия. Количество его очень велико — до 80% от перерабатываемого сильвинита. Галитовые отходы содержат (в сухом веществе) 92—96% NaCl, 1,2—2,5% КС1, 0,6—2% CaS04, 0,05— 0,2% MgCl2, 0,3—3% нерастворимых веществ; влажность их 5— 10% Технические сорта поваренной соли могут быть получены из отходов путем их промывки насыщенным раствором хлорида натрия, например на реечном классификаторе. При этом содержание NaCl повышается до 98%, а содержание примесей снижается (КС1 до 0,30—0,32%). Этот метод переработки отходов наиболее прост и дешев.
Получение более чистой пищевой соли может быть осуществлено растворением отходов, химической очисткой полученного рассола и вакуумной выпаркой его, а также флотацией отходов 17В. Последний метод имеет преимущество перед вакуум-выпаркой, так как не требует расхода пара. Из отходов флотируют примеси, а не основной продукт—так называемая обратная флотация. (Возможна и прямая флотация в присутствии солей свинца или висмута 179.) Хотя флотация и дает продукт с высоким содержанием NaCl (99,7%)), но он загрязнен флотореагентами и имеет неудовлетворительный внешний вид, так как представляет собой не бесцветный (красноватый) тонкий порошок (содержание класса 0,15 мм составляет ~57%).
Промывка галитовых отходов от переработки верхнекамских сильвинитов по специальной технологической схеме 180 позволяет экономично получать пищевую соль хорошего качества. По этой схеме (рис. 3) отходы смешиваются с рассолом NaCl и подвергаются мокрой классификации на дуговых ситах 181 с целью отделения средней фракции с размером —3 + 0,5 мм, содержащей наименьшее количество примесей. Эта фракция при Ж: Т равном 0,7
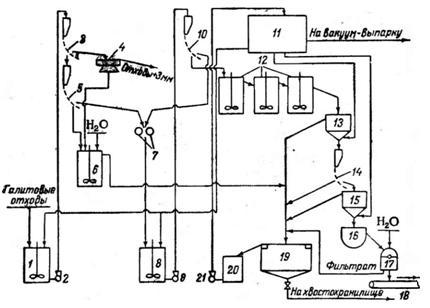
Рис. 3. Схема получения соли 1 сорта помола из галитовых отходов: I, 6 и 8 — мешадаи; 2, 9 и 21 — насосы; 3, 5, 10 и 14 — дуговые сита; 4 — планфильтр; 7 — дро- Ойлка; И — напорный бак; 12 — контактные чаны; 13 и 15 - гидросепараторы; 16 — горизонтальная мешалка; 17 — центрифуга; 18 — транспортер; 19 — отстойник; 20 — сборный бак.
доизмельчается до крупности, соответствующей помолу № 0, и перемешивается в контактных чанах 30—40 мин. При этом растворимые примеси переходят в раствор, а затем пульпа обесшламли- вается в гидросепараторах и на дуговом сите. Загрязненный рассол сливают, а сгущенную пульпу направляют на центрифугу. В ней соль промывается небольшим количеством воды для окончательного вытеснения хлорида калия. Промытую соль высушивают. Загрязненный оборотный рассол после осветления возвращается в процесс, но часть его удаляется для вывода из цикла хлорида калия. При вакуум-выпарке этой части рассола из него можно получать соль «экстра».
Брикетирование и борьба со слеживавмостью соли
центрации суспензии 5 г/л; при этом она равна 1,5 л3/(ж2 • ч) при расходе коагулянта крахмала 0,7 кг на 1 г ила, или 1,9 мя/{м2-ч) при таком же расходе полиакриламида 182. Получаемая соль соответствует по составу первому сорту. Она содержит (в %): Нерастворимый остаток
NaCl98,5—99,0
CaS040, 0,3-0,4
MgCb0,02 — 0,07 KCI
Техническая поваренная соль может быть получена и из отходов флотации КС1 из сильвинита.
Содержание токсичных жирных аминов (используемых в качестве коллектора-собирателя сильвина) во флотационных отходах составляет ~8 г/т, но в солевой фракции их практически нет, так как они адсорбируются на глинистом шламе (в 1 т нерастворимой части отходов содержится ~325 г аминов). Поэтому в готовой технической соли, полученной из отходов флотации, амины отсутствуют.
Для отмывки флотационных отходов галита от аминов предложено также обрабатывать их в классификаторах оборотным маточным раствором; из циркулирующего раствора частицы амина, имеющие размеры 1—100 мк, отделяются фильтрованием через несколько слоев стеклоткани. О приготовлении из отходов флотации сильвинита технического рассола см..
Для внутризаводского перемещения можно использовать гидротранспорт поваренной соли в ее насыщенном растворе с последующим отделением соли в гидроциклоне. Влажность соли из гидроциклона 18—20%
Предложена скоростная разгрузка сухой соли из опрокидывающегося вагона в бетонный бассейн с рассолом, находящийся под колеей. Пульпу (Ж:Т=1:1) перекачивают насосом в хранилище, где кристаллы отделяются от рассола, возвращаемого в бассейн.
|