Министерство образования Российской Федерации
ГИМНАЗИЯ №1
Кафедра Химии
ТВОРЧЕСКАЯ РАБОТА
ИССЛЕДОВАНИЕ СВОЙСТВ ХРОМА И ЕГО СОЕДИНЕНИЙ
Пояснительная записка
Руководитель Г.И. Астахова
Выполнил ученик 9 "В" класса Б.А.Кулаев
Красноярск, 2001 г.
Содержание
Содержание.............................................................................................................................. 2
Введение...................................................................................................................................... 3
1.Исторические сведения............................................................................................ 4
2. Хром в природе.................................................................................................................. 6
3. Свойства хрома. Теоретическая часть...................................................... 7
3.1 Общие сведения............................................................................................................... 7
3.2 Физические свойства.................................................................................................... 8
3.4 Соединения хрома....................................................................................................... 12
3.4.1 Оксиды....................................................................................................................... 12
3.4.2 Гидроксиды.............................................................................................................. 13
3.4.3 Кислоты.................................................................................................................... 13
3.4.4 Соли............................................................................................................................ 14
4. Свойства хрома. Экспериментальная часть...................................... 14
4.1 Опыт №1. Получение оксида хрома (III)............................................................ 14
4.2 Опыт №2. Исследование свойств оксида хрома (III)................................... 15
4.3 Опыт №3.Окислительные свойства солей хрома (VI).................................. 16
4.4 Опыт №4. Исследование свойств солей хрома (VI)...................................... 16
4.5 Опыт №5. Переход хромата в бихромат и обратно....................................... 17
4.6 Опыт №6. Получение малорастворимых солей хромовых кислот....... 17
4.7 Опыт №7. Получение гидроксида хрома........................................................... 18
5. Применение хрома...................................................................................................... 18
5.1 Хромирование................................................................................................................ 20
5.2 Сплавы............................................................................................................................... 22
6. Экологические проблемы................................................................................... 24
Заключение........................................................................................................................... 26
Литература.............................................................................................................................. 27
Приложение А....................................................................................................................... 28
Введение
Хром и его соединения активно используются в промышленном производстве, особенно в металлургии, химической, огнеупорной промышленности. Область его применения достаточно широка, поэтому углубленное изучение свойств хрома является необходимым дополнением к соответствующим разделам школьной программе по химии, тем более, что в учебнике этот материал, по-моему, незаслуженно отсутствует.
Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента.
1.
Исторические сведения
В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец. Спустя несколько лет, в 1770 году, Березовские рудники описал академик П.С.Паллас. «Березовские копи, - писал он, - состоят из четырех рудников, которые разрабатываются с 1752 года. В них наряду с золотом добываются серебро и свинцовые руды, а также находят замечательный красный свинцовый минерал, который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и полупрозрачная... Иногда маленькие неправильные пирамидки этого минерала бывают вкраплены в ква
рц подобно маленьким рубинам. При размельчении в порошок она дает красивую желтую краску...». Минерал был назван «сибирским красным свинцом». Впоследствии за ним закрепилось название «крокоит».
Образец этого минерала был в конце XVIII века привезен Палласом в Париж. Крокоитом заинтересовался известный французский химик Луи Никола Воклен. В 1796 году он подверг минерал химическому анализу. «Все образцы этого вещества, которые имеются в нескольких минералогических кабинетах Европы, - писал Воклен в своем отчете, - были получены из этого (Березовского) золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят, что несколько лет назад запасы минерала в руднике истощились и теперь этот минерал покупают на вес золота, в особенности, если он желтый. Образцы минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся для использования их в живописи, где они ценятся за свою желто-оранжевую окраску, не изменяющуюся на воздухе... Красивый красный цвет, прозрачность и кристаллическая форма сибирского красного минерала заставила минералогов заинтересоваться его природой и местом, где он был найден; большой удельный вес и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о наличии свинца в этом минерале...»
В 1797 году Воклен повторил анализ. Растертый в порошок крокоит он поместил в раствор углекислого калия и прокипятил. В результате опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли образовывался красный осадок, после реакции со свинцовой солью появлялся желтый осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся красные кристаллы (это был оксид шестивалентного хрома) смешал с углем, поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был закончен, ученый обнаружил в тигле множество серых сросшихся металлических иголок, весивших в 3 раза меньше, чем исходное вещество. Так впервые был выделен новый элемент. Один из друзей Воклена предложил ему назвать элемент хромом (по-гречески «хрома» - окраска) из-за яркого разнообразного цвета его соединений. Сначала Воклену не понравилось предложенное название, поскольку открытый им металл имел скромную серую окраску и как будто не оправдывал своего имени. Но друзья все же сумели уговорить Воклена и, после того как французская Академия наук по всей форме зарегистрировала его открытие, химики всего мира внесли слово «хром» в списки известных науке элементов.
В 1854 году удалось получить чистый металлический хром электролизом водных растворов хлорида хрома. В металлургии, где расход хрома для легирования сталей очень велик, используют не сам хром, а его сплав с железом - феррохром. Впервые феррохром был получен в 1820 году восстановлением смеси оксидов железа и хрома древесным углем в тигле. В 1865 году был выдан первый патент на хромистую сталь.
2.
Хром в природе
Среднее содержание хрома в земной коре 83 г/т, по массе содержание
хрома в земной коре составляет 0,035%, в воде морей и океанов 2´10-5
мг/л. Мировые подтвержденные запасы хромовых руд составляют 1,8 млрд. т. Более 60% сосредоточено в ЮАР. Крупными запасами обладают Зимбабве, Казахстан Турция, Индия, Бразилия. Руды хрома имеются в Новой Каледонии, на Кубе, в Греции, Югославии. В то же время такие промышленные страны, как Англия, Франция, ФРГ, Италия, Швеция, совершенно лишены хромового сырья, а США и Канада располагают лишь очень бедными рудами [1]. Запасы хромовых руд России сосредоточены главным образом в группе Сарановских месторождений (Верблюжьегорское, Алапаевское,
Халиловское и др.) на Урале (Пермская область) и составляют 6,4 млн. т. (0,36% от мировых запасов).
Добыча хромовых руд в мире составляет около 12 млн. т. в год, в том числе
108 тыс. т. в России. Главные производители товарной хромовой руды - ЮАР, Казахстан, на долю которых приходится более 60% добычи сырья ежегодно.
В Красноярском крае месторождения хрома отсутствуют. Но на правом берегу р.Енисей, в устье р.Березовой (к югу от устья р. Подкаменная Тунгуска) есть рудопроявление с выходом пород 1,5´4 м, возраст пород оценивается в 500 млн. лет. Содержание чистого хрома в руде порядка 42% .
По содержанию Cr2
O3
хромовые руды подразделяются на очень богатые (более 65%), богатые (65-52%), средние (52-45%), бедные (45-30%), убогие (30-10%). Руды, содержащие более 45% Cr2
O3
не требуют обогащения.
| Показатель |
Донской ГОК
(Казахстан)
|
Сарановская шахта
(Россия, Пермская обл.)
|
Рудопроявление в Красноярском крае |
| Содержание Cr2
O3
в исходной руде, % |
46,6
|
39,1
|
62
|
3. Свойства хрома. Теоретическая часть
3.1
Об
щие сведения
Хром Cr - химический элемент
VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996, радиус атома 0,0125, радиусы ионов Cr2+
- 0,0084; Cr3+
- 0,0064; Cr4+
- 6,0056. Имеет четыре стабильных изотопа с атомными массами 50, 52, 53, 54, распространенность которых в природе составляет 4,35%, 83,79%, 9,50%, 2,36%. Обычно хром проявляет степени окисления +2, +3, +6 (валентности II, III, VI соответственно) [4].Рисунок 1- Структура атома хрома

Рисунок 2-Распределение электронов по энергетическим уровням
3.2
Физические свойства
Хром - твердый, довольно тяжелый, пластичный, ковкий металл серо-стального цвета, плавится при 1
878±220
С, кипит при 24690
С [2]. Ничтожные примеси кислорода, азота, углерода резко изменяют физические свойства хрома, в частности он становится хрупким. Получить хром без этих примесей очень трудно. Устойчив к коррозии на воздухе и в воде.
Структура кристаллической решетки объемноцентрированная кубическая.
Хром обладает всеми характерными свойствами металлов - хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имее
т присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре около 37°С
многие его физические свойства резко, скачкообразно меняются. В этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. Так же внезапно изменяются электропроводность, коэффициент линейного расширения, термоэлектродвижущая сила. Пока ученые не могут достоверно объяснить эту аномалию.
Таблица 1- Физические свойства хрома
| Параметр |
Значение |
| Плотность при 200
C |
7,19 г/см3
|
| Температура плавления |
1878±220
С |
| Температура кипения |
2469-2480 0
C |
| Теплота парообразования |
344,4 кДж/Моль |
| Теплопроводность |
93,7 Вт/(м´К) |
| Температурный коэффициент линейного расширения |
6,2´10-6
|
| Удельное электрическое сопротивление
|
12,7´10-8
Ом´м |
| Твердость по Бринеллю
|
687 МПа |
| Удельная магнитная восприимчивость |
+4,45´10-8
м/кг3
|
3.3
Химические свойства
При небольших температурах хром химически мало активен (взаимодействует только с фтором). Выше 6000
C взаимодействует с галогенами, серой, азотом, кремнием, бором, углеродом, кислородом.
Взаимодействие с кислородом протекает сначала довольно активно, затем, однако, резко замедляется, так как поверхность покрывается тонкой чрезвычайно устойчивой пленкой, препятствующему дальнейшему окислению. Это явление называется пассивированием
. При 12000
C пленка начинает разрушаться, окисление снова идет быстро. При 20000
C хром воспламеняется в кислороде с образованием темно-зеленого оксида Cr2
O3
.
Хром пассивируется холодными концентрированными H2
SO4
и HNO3
, однако при сильном нагревании он растворяется в этих кислотах [3]:
2Cr + 6H2
SO4(
конц
.)
= Cr2
(SO4
)3
+ 3SO2
+ 6H2
O
Cr + 6HNO3(конц.)
= Cr(NO3
)3
+ 3NO2
+ 3H2
O
Хром растворяется в разбавленных сильных кислотах (HCl и H2
SO4
). В этих случаях в отсутствии воздуха образуются соли Cr2+
, а на воздухе - соли Cr3+
:
Cr + 2HCl = CrCl2
+ H2
4Cr + 12HCl +3O2
= 4CrCl3
+ 6H2
O
Нерастворим в H3
PO4
, HClO4
благодаря образованию защитной пленки.
Таблица 2- Основные химические реакции чистого хрома
| Хром реагирует |
| 0…600 0
С |
600…1200 0
С |
1200…2000 0
С |
1. со фтором
2Cr0
+ 3F2
0
= 2Cr+3
F3
-
|
1. с галогенами:
2Cr0
+ 3Cl2
0
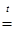 2Cr+3
Cl3
- 2Cr+3
Cl3
-
|
1. с кислородом:
4Cr + 3O2
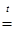 2Cr2
O3 2Cr2
O3
|
2. ссерой:
2Cr0
+ 3S0
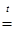 Cr2
+2
S3
-2 Cr2
+2
S3
-2
|
3. с азотом:
2Cr0
+ N2
0
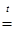 2Cr+3
N-3 2Cr+3
N-3
|
4. с кремнием:
4Cr0
+ 3Si0
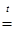 Cr4
+3
Si3
-4 Cr4
+3
Si3
-4
|
5. с бором
Cr0
+ B0
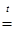 Cr+3
B-3 Cr+3
B-3
|
6. с углеродом
4Cr0
+ 3С0
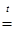 Cr4
+3
C3
-4 Cr4
+3
C3
-4
|
7. с кислородом:
4Cr0
+ 3O2
0
= 2Cr2
+3
O3
-2
|
8. с серной кислотой:
2Cr0
+ 6H2
+
SO4
-2
= Cr2
+3
(SO4
)3
-2
+ 3S-2
O2
+6H2
O
|
3.4 Соединения хрома
3.4.1
Оксиды
Оксид хрома
(II) CrO (основной) - сильный восстановитель, чрезвычайно неустойчив в присутствии влаги и кислорода. Практического значения не имеет.
Оксид хрома
(III) Cr2
O3
(амфотерный) устойчив на воздухе и в растворах.
Cr2
O3
+ H2
SO4
= Cr2
(SO4
)3
+ H2
O
Cr2
O3
+ 2NaOH = Na2
CrO4
+ H2
O
Образуется при нагревании некоторых соединений хрома (VI), например:
4CrO3
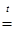 2Cr2
O3
+ 3О2 2Cr2
O3
+ 3О2
(NH4
)2
Cr2
O7
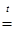 Cr2
O3
+ N2
+ 4H2
O Cr2
O3
+ N2
+ 4H2
O
4Cr + 3O2
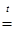 2Cr2
O3 2Cr2
O3
Оксид хрома (III) используется для восстановления металлического хрома невысокой чистоты с помощью алюминия (алюминотермия) или кремния (силикотермия):
Cr2
O3
+2Al = Al2
O3
+2Cr
2Cr2
O3
+ 3Si = 3SiO3
+ 4Cr
Оксид хрома
(VI) CrO3
(кислотный) - темно малиновые игольчатые кристаллы. Получают действием избытка концентрированной H2
SO4
на насыщенный водный раствор б
ихромата калия:
K2
Cr2
O7
+ 2H2
SO4
= 2CrO3
+ 2KHSO4
+ H2
O
Оксид хрома (VI) - сильный окислитель, одно из самых токсичных соединений хрома.
При растворении CrO3
в воде образуется хромовая кислота H2
CrO4
CrO3
+ H2
O = H2
CrO4
Кислотный оксид хрома, ре
агируя со щелочами, образует
желтые хроматы CrO4
2-
.
CrO3
+ 2KOH = K2
CrO4
+ H2
O
3.4.2
Гидроксиды
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь как в кислотах (ведет себя как основание):
2Cr(OH)3
+ 3H2
SO4
= Cr2
(SO4
)3
+ 6H2
O
так и в щелочах (ведет себя как кислота):
Cr(OH)3
+ KOH = K[Cr(OH)4
]
Cr(OH)3
+ NaOH = NaCrO2
+ 2H2
O
При прокаливании гидроксида хрома (III) образуется оксид хрома (III) Cr2
O3
.
2Cr(OH)3
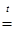 Cr2
O3
+ 3H2
O Cr2
O3
+ 3H2
O
Нерастворим в воде.
3.4.3 Кислоты
Кислоты хрома, отвечающие его степени окисления +6 и различающиеся соотношением числа молекул CrO3
и H2
O, существуют только в виде растворов. При растворении кислотного оксида CrO3
, образуется монохромовая кислота (просто хромовая) H2
CrO4
.
CrO3
+ H2
O = H2
CrO4
Подкисление раствора или увеличение в нем CrO3
приводит к кислотам общей формулы nCrO3
H2
O при n=2, 3,
4 это, соответственно, ди, три, тетрохромовые кислоты. Самая сильная из них - дихромовая, то есть H2
Cr2
O7
. Хромовые кислоты и их соли- сильные окислители и ядовиты.
3.4.4
Соли
Различают
два вида солей: хромиты и хроматы
Хромитами
с общей формулой RCrO2
называются соли хромистой кислоты HCrO2
.
Cr(OH)3
+ NaOH = NaCrO2
+ 2H2
O
Хромиты обладают различной окраской - от темно коричневой до совершенно черной и обычно встречаются в виде сплошных массивов. Хромит мягче многих других минералов, температура плавления хромита зависит от его состава 1545-17300
С. Хромит имеет металлический блеск и почти нерастворим в кислотах.
Хроматы
- соли хромовых кислот. Соли монохромовой кислоты H2
CrO4
называют монохроматами (хроматы) R2
CrO4
, соли дихромовой кислоты H2
Cr2
O7
дихроматы (бихроматы) - R2
Cr2
O7
. Монохроматы обычно окрашены в желтый цвет. Они устойчивы только в щелочной среде, а при подкислении превращаются в оранжево-красные бихроматы:
2Na2
CrO4
+ H2
SO4
= Na2
Cr2
O7
+ Na2
SO4
+ H2
O
4. Свойства хрома. Экспериментальная часть
4.1
Опыт №1.
Получение оксида хрома (III)
Приборы и реактивы
: асбестированная сетка; спички; бихромат аммония (NH4
)2
Cr2
O7
(измельченный).
Выполнение опыта
. Расстилаю большой лист бумаги, на который кладу асбестированную сетку. Тонко измельченный бихромат аммония насыпаю в виде горки. До бихромата аммония дотрагиваюсь зажженной спичкой.
Начинается разложение бихромата, которое протекает с выделением тепла и постепенно захватывает все большие и большие количества соли. В конце реакция идет все более бурно - появляются искры, пламя, летит рыхлый и легкий пепел - типичное извержение вулкана в миниатюре. Образовалось большое количество рыхлого темно-зеленого вещества.
Вывод
: оксид хрома (III) Cr2
O3
получается путем нагревания бихромата аммония:
(NH4
)2
Cr2
O7
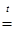 Cr2
O3
+N2
+4H2
O Cr2
O3
+N2
+4H2
O
4.2
Опыт №2. Исследование свойств оксида хрома (
III)
Приборы и реактивы
: колба; вода H2
O; оксид хрома (III) Cr2
O3
; серная кислота
Выполнение опыта
. Добавляю полученный зеленый порошок оксида хрома (III) сначала в колбу с водой
Cr2
O3
+ 3H2
O = 2Cr(OH)3
затем в колбу с серной кислотой
Cr2
O3
+ 3H2
SO4
= Cr2
(SO4
)3
+ 3H2
O
Наблюдаю растворение оксида в обоих колбах.
Вывод:
Оксид хрома растворяется в воде и в кислотах.
4.3
Опыт №3.
Окислительные свойства солей хрома (
VI)
Приборы и реактивы
: раствор бихромата калия K2
Cr2
O7
; раствор сульфита натрия Na2
SO3
; серная кислота H2
SO4
.
Выполнение опыта
. К раствору K2
Cr2
O7
, подкисленному серной кислотой, добавляю раствор Na2
SO4
. Наблюдаю изменения окраски.
Оранжевый раствор стал зелено- фиолетовым.
Вывод:
В кислой среде хром восстанавливается сульфитом натрия от хрома (VI) до хрома (III):
K2
Cr2
O7
+ 3Na2
SO3
+ 4H2
SO4
= K2
SO4
+ Cr2
(SO4
)3
+ 3Na2
SO4
+ 4H2
O
4.4
Опыт
№4. Исследование свойств солей хрома (
VI)
Приборы и реактивы
: концентрированный раствор бихромата калия K2
Cr2
O7
; концентрированная соляная кислота HCl
Выполнение опыта
. К концентрированному раствору бихромата калия K2
Cr2
O7
добавляю концентрированную соляную кислоту HCl. При нагревании наблюдается выделение резкого хлорного запаха, от которого жжет нос и горло.
Вывод:
Так как все соединения хрома (VI) являются сильными окислителями, то при реакции с соляной кислотой:
K2
Cr2
O7
+ 14HCl 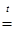 3Cl2
+ 2CrCl3
+ 2KCl + 7H2
O 3Cl2
+ 2CrCl3
+ 2KCl + 7H2
O
происходит восстановление хлора:
2Cl-
-2 Cl2
0 Cl2
0
4.5
Опыт №5. Переход хромата в бихромат и обратно
Приборы
и реактивы:
раствор хромата калия K2
CrO4
, раствор бихромата калия K2
Cr2
O7
, серная кислота, гидроксид натрия.
Выполнение опыта.
К раствору хромата калия добавляю серную кислоту, в результате происходит изменение окраски раствора из желтого в оранжевый.
2K2
CrO4
+ H2
SO4
= K2
Cr2
O7
+ K2
SO4
+ H2
O
К раствору бихромата калия добавляю щелочь, в результате происходит изменение окраски раствора из оранжевого в желтый.
K2
Cr2
O7
+ 4NaOH = 2Na2
CrO4
+ 2KOH + H2
O
Вывод:
В кислой среде хроматы неустойчивы, ион CrO4
2-
желтого цвета превращается в ион Cr2
O7
2-
оранжевого цвета, а в щелочной среде эта реакция протекает в обратном направлении
2CrO4
2-
+ 2H+
кислая среда
®
¬
щелочная среда
Cr2
O7
2-
+ H2
O.
4.6
Опыт №6. Получение малорастворимых солей хромовых кислот
Приборы и реактивы:
раствор хромата калия K2
CrO4
, раствор бихромата калия K2
Cr2
O7
, раствор нитрата серебра AgNO3
.
Выполнение опыта.
Наливаю в одну пробирку раствор хромата калия, в другую - раствор бихромата калия, и добавляю в обе пробирки раствор нитрата серебра, в обоих случаях наблюдаю образование красно-бурого осадка.
K2
CrO4
+ 2AgNO3
= Ag2
CrO4
¯ + 2KNO3
K2
Cr2
O7
+ AgNO3
® Ag2
CrO4
¯+ KNO3
Вывод:
Растворимые соли хрома при взаимодействии с нитратом серебра образуют нерастворимый осадок
4.7
Опыт №7
. Получение гидроксида хрома
Приборы и реактивы:
раствор солихрома (III) CrCl3
, едкий натр (гидроксид натрия) NaOH.
Выполнение опыта.
В пробирку с раствором хлорида хрома (III) по каплям добавляю раствор едкого натра до образования серо-зеленого осадка.
Вывод:
Гидроксид хрома Cr(OH)3
получается при действии на соль трехвалентного хрома щелочью:
CrCl3
+ 3NaOH = Cr(OH)3
¯ + 3NaCl
5.
Применение хрома
Основная часть добываемой в мире хромистой руды поступает сегодня на ферросплавные заводы, где выплавляются различные сорта феррохрома и металлического хрома.
Хромиты широко используют в огнеупорной
промышленности для изготовления огнеупорного хромитового и хромомагнезитового кирпича. Такой кирпич химически пассивен, устойчив при температурах выше 22000
С, хорошо выдерживает резкие колебания температур. Магнезитохромитовый кирпич - отличный огнеупорный материал для футеровки (защитной внутренней облицовки) мартеновских печей и других металлургических агрегатов. Своды из хромомагнезитового кирпича выдерживают вдвое больше плавок, чем своды из упорного кварцевого материала.
Химики
используют хромиты для получения бихроматов калия и натрия, а также хромовых квасцов, которые применяются для дубления кожи, придающего ей красивый блеск и прочность. Такую кожу называют «хромом», а сапоги из нее «хромовыми». Растворимые в воде хроматы натрия и калия применяются в текстильном и кожевенном производстве, как консерванты древесины (они уничтожают древесные грибки).
Хромовая смесь - сернокислый раствор бихромата калия или натрия используется для мытья химической посуды в лабораториях. Наиболее часто применяется раствор содержащей по массе приблизительно 12 частей K2
Cr2
O7
, 70 частей воды и 22 части H2
SO4
.
Как бы оправдывая свое название, хром принимает деятельное участие в производстве красителей для стекольной, керамической, текстильной
промышленности. Нерастворимые хроматы некоторых металлов (PbCrO4
, ZnCrO4
, SrCrO4
) - прекрасные художественные краски. Богатством оттенков - от розово-красного до фиолетового славится SnCrO4
, используемый в живописи по фарфору.
В мире драгоценных камней рубину принадлежит второе место после алмаза. Технология получения искусственного рубина заключается в следующем: в оксид алюминия Al2
O3
вводят дозированную добавку оксида хрома (III), - ему-то и обязаны рубиновые кристаллы своим чарующим цветом. Но искусственные рубины ценятся не только за свои «внешние данные»: рожденный с их помощью лазерный луч способен буквально творить чудеса.
Оксид хрома (III) позволил тракторостроителям значительно сократить сроки обкатки двигателей. Обычно эта операция, во время которой все трущиеся детали должны «привыкнуть» друг к другу, продолжалась довольно долго и это, конечно, не очень устраивало работников тракторных заводов. Выход из положения был найден, когда удалось разработать новую топливную присадку, в состав которой вошел оксид хрома (III). Секрет действия присадки прост: при сгорании топлива образуются мельчайшие абразивные частицы оксида хрома (III), которые, оседая на внутренних стенках цилиндров и других подвергающихся трению поверхностях, быстро ликвидируют шероховатости, полируют и плотно подгоняют детали. Эта присадка в сочетании с новым сортом масла позволила в 30 раз сократить продолжительность обкатки.
Замена в рабочем слое магнитофонной пленки оксида железа на частицы оксида хрома (III) позволила резко улучшить качество звучания, пленка стала надежнее в работе.
Фотоматериалы и лекарства, катализаторы для химических процессов и металлические покрытия - всюду хром оказывается «при деле». О хромовых покрытиях следует рассказать подробнее.
5.1
Хром
и
рование
Давно было замечено, что хром не только отличается большой твердостью (в этом отношении у него нет конкурентов среди металлов), но и хорошо сопротивляется окислению на воздухе, не взаимодействует с кислотами. Тонкий слой этого металла попробовали электролитически осаждать на поверхность изделий из других материалов, чтобы предохранить их от коррозии, царапин и прочих «травм». Однако хромовые покрытия оказались пористыми, легко отслаивались и не оправдывали возлагаемых на них надежд.
Почти три четверти века бились ученые над проблемой хромирования, и лишь в 20-х годах прошлого столетия проблема была решена. Причина неудач заключалась в том, что используемый при этом электролит содержал трехвалентный хром, который не мог создать нужное покрытие. А вот его шестивалентному «собрату» такая задача оказалась по плечу. С этого времени в качестве электролита начали применять хромовую кислоту - в ней валентность хрома равна 6. Толщина защитных покрытий (например, на некоторых наружных деталях автомобилей, мотоциклов, велосипедов) составляет до 0,1 миллиметра. Но иногда хромовое покрытие используют в декоративных целях - для отделки часов, дверных ручек и других предметов, не подвергающихся серьезной опасности. В таких случаях на изделие наносят тончайший слой хрома (0,0002-0,0005 миллиметра).
Литовские химики разработали способ создания многослойной «кольчуги» для особо ответственных деталей. Тончайший верхний слой этого покрытия (под микроскопом его поверхность и в самом деле напоминает кольчугу) состоит из хрома: в процессе службы он первым «принимает огонь на себя», но пока хром окисляется, проходят многие годы. Тем временем деталь спокойно несет свою ответственную службу.
Хромированию подвергаются не только металлические детали, но и изделия из пластмасс. Подвергнутый испытаниям широко известный полимер - полистирол, «одетый» в хром, стал прочнее, для него оказались менее страшными такие известные «враги» конструкционных материалов, как истирание, изгиб, удар. Само собой разумеется, возрос срок службы деталей.
Существует и другой способ хромирования - диффузионный, протекающий не в гальванических ваннах, а в печах. Первоначально стальную деталь помещали в порошок хрома и нагревали в восстановительной атмосфере до высоких температур. При этом на поверхности детали появлялся обогащенный хромом слой, по твердости и коррозионной стойкости значительно превосходящий сталь, из которой сделана деталь. Но при температуре примерно 1000°С хромовый порошок спекается и, кроме того, на поверхности покрываемого металла образуются карбиды, препятствующие диффузии хрома в сталь. Пришлось подыскивать другой носитель хрома; вместо порошка для этой цели начали использовать летучие галоидные соли хрома - хлорид или иодид, что позволило снизить температуру процесса. Хлорид (или иодид) хрома получают непосредственно в установке для хромирования, пропуская пары соответствующей галоидоводородной кислоты через порошкообразный хром или феррохром. Образующийся газообразный хлорид обволакивает хромируемое изделие, и поверхностный слой насыщается хромом. Такое покрытие гораздо прочнее связано с основным материалом, чем гальваническое.
5.2
Сплавы
Семейство хромовых сплавов весьма многочисленно.
Таблица 3- Основные хромовые сплавы
| Название |
Хром
Cr
|
Железо
Fe
|
Никель
Ni
|
Алюминий
Al
|
Кобальт
Co
|
Вольфрам
W
|
| Феррохром
|
65% |
35 % |
| Нихром
|
15-30% |
70-85% |
| Хромаль
|
17-30% |
64-79% |
4-6% |
| Стеллит
|
20-25% |
1-3% |
45-60% |
5-29% |
Феррохром -
сплав хрома с железом, вводимый в жидкую сталь для ее легирования. Вводить хром в чистом виде в сталь очень затруднительно - он медленно растворяются в жидком металле, так как температуры его плавления выше, чем у стали. У феррохрома же температура плавления такая же, как у стали, или ниже.
Нихромы
и хромали,
устойчивы в интервале 1000-13000
C, обладают высоким электросопротивлением, используются для изготовления нагревателей в электрических печах сопротивления.
Добавка к хромоникелевым сплавам кобальта и молибдена придает металлу способность переносить большие нагрузки при 650-900° С. Из этих сплавов делают, например, лопатки газовых турбин.
Стеллит
очень твердый сплав, стоек против износа и коррозии; применяется в металлообрабатывающей промышленности, для изготовления режущих инструментов.
Комохром -
сплав хрома, кобальта и молибдена безвреден для человеческого организма и поэтому используется в восстановительной хирургии.
Хром входит в состав очень многих марок сталей.
«Нержавейка» - сталь, отлично противостоящая коррозии и окислению, содержит примерно 17-19% хрома и 8-13% никеля. Но этой стали углерод вреден: карбидообразующие «наклонности» хрома приводят к тому, что большие количества этого элемента связываются в карбиды, выделяющиеся на границах зерен стали, а сами зерна оказываются бедны хромом и не могут стойко обороняться против натиска кислот и кислорода. Поэтому содержание углерода в нержавеющей стали должно быть минимальным (не более 0,1%).
При высоких температурах сталь может покрываться «чешуей» окалины. В некоторых машинах детали нагреваются до сотен градусов. Чтобы сталь, из которой сделаны эти детали, не «страдала» окалинообразованием, в нее вводят 25-30% хрома. Такая сталь выдерживает температуры до 1000°С.
Хромолибденовые стали используются для создания фюзеляжей самолетов.
6.
Экологические проблемы
(Влия
ние геологоразведочных работ, добычи и переработки сырья на окружающую среду)
Хром относится к высоко токсичным веществам. Действие на живой организм солей хрома сопровождается раздражением кожи или слизистой оболочки, иногда с образованием язв. Поражают они главным образом верхние дыхательные пути, легкие и глаза. Оксиды хрома менее токсичны, чем чистый металл.
Таблица 4-Предельно допустимые концентрации оксидов хрома
|
|
CrO3
|
Cr2
O3
|
| Разовая в воздухе населенных мест, мг/м3
|
0,01 |
1,0 |
| Суточная в воздухе населенных мест мг/м3
|
0,0015 |
- |
| В воде для хозяйственно-питьевого и культурно-бытового водоснабжения, мг/л |
0,1 |
1,0 |
| В воде для рыбохозяйственных целей, мг/л |
0,1 |
0,5 |
При проведении геологоразведочных работ на хромовые руды не требуются специальные меры по защите окружающей среды. При добыче хромовых руд для исключения попадания рудной пыли в воздух населенных пунктов следует выполнять ряд условий: соблюдение определенного расстояния от населенных пунктов, орошение дорог в карьерах и в складах добытой руды.
Наиболее значительное нарушение окружающей среды связано с переработкой хромового сырья, при котором в воздух попадает значительное количество пыли при сухом долблении и сортировке. При мокром обогащении сточные воды нуждаются в отчистке от хрома, его оксидов, что исключает сброс сточных вод в водоемы и требует строительства экранированных шламохранилищ.
Заключение
В данной работе рассмотрены основные вопросы изучения свойств
хрома- химического элемента VI группы периодической системы Менделеева.
В первых двух разделах реферата кратко изложены факты открытия и дальнейшего использования хрома, указана особенность распространения хрома в природных месторождениях: хром никогда не встречается в несвязанном состоянии.
Далее рассмотрены физические свойства хрома. Отмечены
аномальные изменения физических свойств хрома при температуре 370
С.
Основные разделы реферата посвящены изучению химических свойств хрома и его соединений. Отмечены малая химическая активность хрома, сильные окислительные свойства и высокая токсичность его соединений.
Отдельный раздел посвящен экспериментальному исследованию свойств основных практически значимых соединений хрома - оксидов, гидроксидов и солей
. Все опыты подтверждены соответствующими химическими реакциями. Результаты экспериментов могут быть использованы при формировании лабораторного практикума по разделу "Металлы" курса химии школьной программы.
Также в реферате рассмотрены вопросы промышленного применения хрома и экологические проблемы его добычи и переработки.
Литература
1. Лисицын А.Е., Остапенко П.Е. Минеральное сырье. Хром // Справочник. - М.: ЗАО Геоинформмарк, 1999. - 25 с.
2. Салли А., Брендз Э. Хром.- Изд. 2-е переработ. и доп. Перев. с англ. М.: Металлургия, 1971.- 360 с.
3. Химия. Решение задач: учеб. пособие для уч. сред. и ст. шк. в
озраста/ Авт.- сост. А.Е.Хасанов. - Мн.: Современный литератор, 1999. -448 с.
4. Неорганическая химия. Энциклопедия школьника/ Гл. ред. И.П.Алимарин.- М.: Советская Энциклопедия, 1975.- 384 с.
5. Энциклопедический словарь юного химика/ Сост. В.А.Крицман, В.В.Станцо.- М.: Педагогика, 1982.- 368 с.
Приложение А
(справочное)
Таблица А.1-Важнейшие природные соединения хрома
| Название минерала |
Химическая формула |
|
Хромистый железняк |
FeO*Cr2
O3
или FeCr2
O4
|
| Магнезиохромит |
MgO*Cr2
O3
или MgCr2
O4
|
| Алюмохромит |
FеО*(Аl,Сr)2
O3
или Fe(Al,Cr)2
O4
|
| Пикотит |
(Mg,Fe)(Al,Сr,Fе)2
O3
, или (Mg,Fe)O*(AI,Сr,Fе)2
О3
|
| Хромитит |
(Fe*Al)2
O3
*2Cr2
O3
|
| Добреслит |
FeS*Cr2
S3
|
| Крокоит |
PbCrO4
|
| Вокеленит |
2(Pb*Cu)CrO4
(Pb*Cu)3
(PO4
)2
|
| Феницит |
3PbO*2Cr2
O3
|
| Березовит |
(PbO)2
*(PbCrO4
)PbCrO3
|
Таблица А.2-Свойства оксидов хрома
| валентность |
обозначение |
свойства |
| II |
CrO |
основной |
восстановитель |
| III |
Cr2
O3
|
амфотерный |
| VI |
CrO3
|
кислотный |
окислитель |
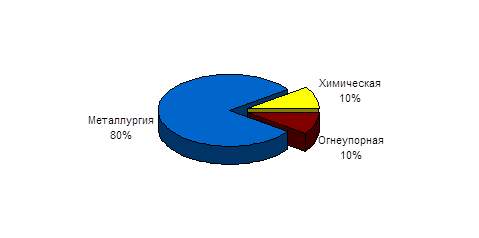
Рисунок А.1- Структура применения хрома по отраслям промышленности
|