Историческая справка.
Название элемента №42 происходит от латинского слова molybdaena, которым в средние века обозначали все минералы способные оставлять след на бумаге: и графит, и галенит Pbs, и даже сам свинец. И ещё минерал, который сейчас называют молибденитом, или молибденовым блеском. Впоследствии оказалось, что этот минерал тогда ещё неизвестного элемента №42. Но до середины 18-го века молибденит и графит не различали, лишь в 1758 г. известный шведский химик и минералог Аксель Фредерик Кронстедт предположил, что это самостоятельных вещества, но прошло ещё 20 лет, прежде чем это сумели доказать на опыте.
Минерал, которым писали, попал в лабораторию другого большого химика, Карла Вильгельма Шееле. Первое, что он сделал, это исследовал, как на этот минерал действуют крепкие кислоты. В концентрированной азотной кислоте минерал растворился, но при этом в колбе выпал белый осадок. Высушив его и исследовав, Шееле установил, что особая белая земля обладает свойствами кислотного окисла.
В то время химики ещё не имели чёткого представления о том, что ангидрид(«кислота-вода») – это соединение элемента с кислородом. Однако собственный опыт подсказывал учёному: чтобы выделить элемент из «земли», нужно прокалить её с чистым углем. Но для этого у Шееле не было подходящей печи. И он попросил проделать этот опыт другого химика, Гьельма, у которого такая печь была. Гьельм согласился.
Лишённый чувств зависти, беззаветно преданный науке, Шееле с волнением ждал результата. И когда опыты завершились получением неизвестного металла, Шееле написал Гьельму: «Радуюсь, что мы теперь обладаем металлом – молибденом».
Это было в 1790 г. Новый металл получил имя – чужое имя, потому что латинское molibdaena происходит от древнегреческого названия свинца – μολνβδος. В этом есть парадокс – трудно найти металлы более несхожие чем молибден и свинец.
Но металл полученный Шееле и Гьельмом, не был чистым: при прокаливании с углем трёхокиси молибдена МоО3 невозможно получить чистый Мо, т.к. он реагирует с углем, образуя карбид.
Уже после смерти обоих первооткрывателей их знаменитый соотечественник Берцелиус восстановил молибденовый ангидрид не углем, а водородом, получил чистый молибден, установил его атомный вес и подробно исследовал его свойства.
Распространение в природе и месторождения молибдена.
Молибден принадлежит к малораспространённым элементам. Среднее содержание его в земной коре составляет 3*10-4%(по массе). Концентрация молибдена в рудах незначительна. Эксплуатируются руды, содержащие десятые и даже сотые доли процента молибдена.
Различают несколько видов молибденовых руд:
1. простые кварцево-молибденовые руды, в которых молибденит залегает в кварцевых жилах.
2. Кварцево-молибдено-вольфрамитовые руды, содержащие наряду с молибденитом вольфрамит.
3. Скарновые руды. В рудах этого типа молибденит часто с шеелитом и некоторыми сульфидами(перит, халькоперит) залегают в кварцевых жилах, заполняющих трещины в скарнах(окременённых известняках).
4. Медно-молибденовые руды, в которых молибденит сочетается с сульфидами меди и железа. Это наиболее важный источник получения молибдена.
Наиболее значительные месторождения молибденовых руд в зарубежных странах сосредоточены в западной части США, Мексике, Чили, юго-восточной части Канады, южной Норвегии и восточных штатах Австралии.
В России эксплуатируется ряд месторождений молибденовых руд, обеспечивающих потребность отечественной промышленности в молибдене( на Северном Кавказе и Закавказье, Красноярском крае и др. районах).
Производство молибдена.
Все способы получения вольфрама применимы и для получения молибдена. Трёхокись молибдена может быть восстановлена до металла водородом, углеродом и углесодержащими газами, а также металлотермическим методом алюминием и кремнием.
Промышленный способ производства чистого порошкообразного молибдена, превращаемого затем в компактный металл, состоит в восстановлении трехокиси молибдена водородом.
Чистую трехокись молибдена, необходимую для производства металла, получают прокаливанием при 450 – 500˚С парамолибдата аммония в муфельных печах с вращающейся трубой.
При восстановлении трёхокиси молибдена водородом отчётливо выявляются две стадии восстановления:
  МоО3 + Н2 МоО2 + Н2О; МоО3 + Н2 МоО2 + Н2О;
  МоО2 + 2Н2 Мо + 2Н2О; МоО2 + 2Н2 Мо + 2Н2О;
Промежуточные окислы( Мо4О 11 и др.), вероятно, образуются в результате вторичного взаимодействия между МоО3 и МоО2 .
Реакция первой стадии восстановления экзотермическая:
∆Н˚298 = -20,3ккал; ∆G˚= -21,289ккал.
Реакция второй стадии восстановления экзотермическая:
∆Н˚298 =+25,2ккал.
В соответствии с высокими значениями Кр первую стадию восстановления проводят при низких температурах 459 - 550˚С. вторую стадию вследствие малых значений Кр при высоких температурах(900 - 1100˚С) остроосушённым водородом.
 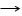 Восстановление трёхокиси молибдена в производственных условиях ведут в две или три стадии. Первую стадию( МоО3 МоО2) осуществляют при подъёме температуры вдоль трубы печи, по которой передвигаются лодочки, от 450 - 650˚С, причём образование двуокиси молибдена должно в основном закончиться до достижения 550˚С, так как промежуточный окисел даёт легкоплавкую эвтектику с МоО3 , плавящуюся при 550 - 600˚С. скорость продвижки лодочек примерно 20 мм/мин. Расход водорода на одну трубу диаметром 51 мм 0,5 – 0,7м³/час. На второй стадии восстановления(МоО2 Мо) температуру вдоль печи изменяют от 650 - 950˚С, причем используется хорошо осушенный водород росы(-40)÷(-50˚С). после второго восстановления порошки молибдена ещё содержат 0,5 – 1,5% кислорода в зависимости от скорости продвижения лодочек. Скорость движения лодочек на второй стадии в 2 – 2,5 раза ниже, чем на первой, а расход водорода в 1,5 – 2 раза выше. Для снижения содержания кислорода обычно применяют дополнительное третье восстановление при 1000 - 1100˚С. Восстановление трёхокиси молибдена в производственных условиях ведут в две или три стадии. Первую стадию( МоО3 МоО2) осуществляют при подъёме температуры вдоль трубы печи, по которой передвигаются лодочки, от 450 - 650˚С, причём образование двуокиси молибдена должно в основном закончиться до достижения 550˚С, так как промежуточный окисел даёт легкоплавкую эвтектику с МоО3 , плавящуюся при 550 - 600˚С. скорость продвижки лодочек примерно 20 мм/мин. Расход водорода на одну трубу диаметром 51 мм 0,5 – 0,7м³/час. На второй стадии восстановления(МоО2 Мо) температуру вдоль печи изменяют от 650 - 950˚С, причем используется хорошо осушенный водород росы(-40)÷(-50˚С). после второго восстановления порошки молибдена ещё содержат 0,5 – 1,5% кислорода в зависимости от скорости продвижения лодочек. Скорость движения лодочек на второй стадии в 2 – 2,5 раза ниже, чем на первой, а расход водорода в 1,5 – 2 раза выше. Для снижения содержания кислорода обычно применяют дополнительное третье восстановление при 1000 - 1100˚С.
Вместимость лодочек на второй стадии восстановления примерно в 2 раза выше, а на третьей – в 5 раз выше, чем на первой, что объясняется различием в насыпной массе МоО3 (0,4 - 0,5г/см³), МоО2 (1 – 1,5 г/см³) и Мо(~2,5г/см³).
Первую и вторую стадию восстановления ведут в печах с 9 – 11 трубами из хромоникелевой стали.
При 1000 - 1100˚С стойкость труб из хромоникелевой стали и нихромовых электронагревателей при соприкосновении с воздухом заметно снижается. Поэтому третье восстановление проводят в трубчатых печах с герметичным кожухом, заполненных водородом для защиты труб и нагревателей от окисления.
После третьего восстановления порошки молибдена содержат примерно 0,25 – 0,3% кислорода.
Средний размер частиц порошков молибдена 0,5-2мкм. Они мельче, чем частицы порошка вольфрама, что объясняется низкой температурой первой стадии восстановления, при которой окислы заметно не испаряются.
В последнее время для первой стадии восстановления начали применять барабанные печи непрерывного действия.
Свойства молибдена
По физическим, механическим и химическим свойствам молибден (Мо) близок вольфраму (W), хотя несколько отличается от него.
Физические свойства Мо приведены ниже.
| Атомный номер |
42 |
| атомная масса |
95,95 |
| плотность, г/см3 |
10,2 |
| тип и период решётки |
ОЦК |
| температура плавления, С |
2620 |
| температура кипения, С |
4800 |
| температура перехода в сверхпроводящее состояние, К |
0,9-0,98 |
| теплота плавления, кал/г |
50 |
| теплота сублимации, кал/г |
1620 |
| удельная теплоёмкость(при 20-100град), кал/(г*С ) |
0,065 |
| теплопроводность(при 20град С), кал/(см*с*С) |
0,35 |
| коэффициент расширения(25-700град С) |
5,8-6,2*10 |
| работа выхода электронов, эВ |
4,37 |
| сечение захвата тепловых нейтронов, барн |
2,6 |
| модуль упругости для проволоки, кгс/мм2 |
28500-30000 |
Молибден относится к тугоплавким металлам. Полее высокие точки плавления имеют только вольфрам, рений и тантал. Среди других физических свойств молибдена необходимо отметить высокую температуру кипения и электропроводность (меньше чем у меди, нобольше, чем у железа и никеля) и сравнительно малый коэффициент линейного расширениия( примерно 30% от коэфф расширения меди). Твёрдость и предел прочности ниже, чем у вольфрама. Он легче потдаётся обработке давлением. Механические свойства сильно зависят от чистоты металла и предшествующей механической и термической его обработки. Важное свойство молибдена – малое сечение захвата тепловых нейтронов, что делает возможным его применение в качестве кострукционного материала в ядерных реакторах.
На воздухе при обычной температуре Мо стоек. Легкое окисление наблюдается при 400˚С. выше 600˚С металл быстро окисляется с образованием МоО3 . пары воды выше 700˚С интенсивно окисляют Мо до двуокиси молибдена МоО2.
С водородом молибден химически не взаимодействует вплоть до плавления. Однако при нагревании металла во водороде происходит некоторое поглощение газа с образованием твёрдого растврора.
При обычной температуре молибден стоек в соляной и серных кислотах , но несколько растворяется при 80 - 100˚. Азотная кислота и царская водка медленно растворяют молибден на холоде и быстро при нагревании.
Металл растворяется в перекиси водорода с образованием пероксо кислот Н2МоО6 и Н2МоО11.
В плавиковой кислоте молибден устойчив, но в смеси ее с азотной кислотой быстро растворяется. Хорошим растворителем молибдена служит смесь пяти объёмов азотной кислоты, трёх объёмов серной кислоты, и двух объёмов воды. Эта смесь используется для растворения молибденовых кернов после навивки вольфрамовых спиралей.
В холодных растворах щелочей молибден стоек, но несколько разъедается горячими растворами. Металл интенсивно окисляется расплавленными щелочами, особенно в присутствии окислителей, образуя соли молибденовой кислоты.
Министерство Высшего Профессионального Образования Российской Федерации
УГАТУ
Кафедра Химии
Контролируемая самостоятельная работа студента
Выполнил: Мистер Икс
ЛП-1**
Проверил: Беляева Л.С.
Уфа– 200*
|