Доктор биологических наук Е. П. Харченко, М. Н. Клименко
Уровни пластичности
В начале нынешнего столетия исследователи мозга отказались от традиционных представлений о структурной стабильности мозга взрослого человека и невозможности образования в нём новых нейронов. Стало ясно, что пластичность взрослого мозга в ограниченной степени использует и процессы нейроногенеза.
Говоря о пластичности мозга, чаще всего подразумевают его способность изменяться под влиянием обучения или повреждения. Механизмы, ответственные за пластичность, различны, и наиболее совершенное её проявление при повреждении мозга — регенерация. Мозг представляет собой чрезвычайно сложную сеть нейронов, которые контактируют друг с другом посредством специальных образований — синапсов. Поэтому мы можем выделить два уровня пластичности: макро- и микроуровень. Макроуровень связан с изменением сетевой структуры мозга, обеспечивающей сообщение между полушариями и между различными областями в пределах каждого полушария. На микроуровне происходят молекулярные изменения в самих нейронах и в синапсах. На том и другом уровне пластичность мозга может проявляться как быстро, так и медленно. В данной статье речь пойдёт в основном о пластичности на макроуровне и о перспективах исследований регенерации мозга.
Существуют три простых сценария пластичности мозга. При первом происходит повреждение самого мозга: например, инсульт моторной коры, в результате которого мышцы туловища и конечностей лишаются контроля со стороны коры и оказываются парализованными. Второй сценарий противоположен первому: мозг цел, но повреждён орган или отдел нервной системы на периферии: сенсорный орган — ухо или глаз, спинной мозг, ампутирована конечность. А поскольку при этом в соответствующие отделы мозга перестаёт поступать информация, эти отделы становятся „безработными“, они функционально не задействованы. В том и другом сценарии мозг реорганизуется, пытаясь восполнить функцию повреждённых областей с помощью неповреждённых либо вовлечь „безработные“ области в обслуживание других функций. Что касается третьего сценария, то он отличен от первых двух и связан с психическими расстройствами, вызванными различными факторами.
Немного анатомии
На рис. 1 представлена упрощённая схема расположения на наружной коре левого полушария полей, описанных и пронумерованных в порядке их изучения немецким анатомом Корбинианом Бродманом.

Рис. 1. Наружная кора левого полушария головного мозга: поля Бродмана. Специально выделены первичные сенсорные области: зрительная — 17, слуховая — 41 и соматосенсорная — 1, 2, 3
(в совокупности их принято называть сенсорной корой), моторная (4) и премоторная (6) кора.
Передний мозг (лобная доля) выделен штриховкой, задний (височная, теменная, затылочная доли) — серым
|
Каждое поле Бродмана характеризуется особым составом нейронов, их расположением (нейроны коры образуют слои) и связями между ними. К примеру, поля сенсорной коры, в которых происходит первичная переработка информации от сенсорных органов, резко отличаются по своей архитектуре от первичной моторной коры, ответственной за формирование команд для произвольных движений мышц. В первичной моторной коре преобладают нейроны, по форме напоминающие пирамиды, а сенсорная кора представлена преимущественно нейронами, форма тел которых напоминает зерна, или гранулы, почему их и называют гранулярными.
Обычно мозг подразделяют на передний и задний (рис. 1). Области коры, прилегающие в заднем мозге к первичным сенсорным полям, называют ассоциативными зонами. Они перерабатывают информацию, поступающую от первичных сенсорных полей. Чем сильнее удалена от них ассоциативная зона, тем больше она способна интегрировать информацию от разных областей мозга. Наивысшая интегративная способность в заднем мозге свойственна ассоциативной зоне в теменной доле (на рис. 1 не окрашена).
В переднем мозге к моторной коре прилегает премоторная, где находятся дополнительные центры регуляции движения. На лобном полюсе расположена другая обширная ассоциативная зона — префронтальная кора. У приматов это наиболее развитая часть мозга, ответственная за самые сложные психические процессы. Именно в ассоциативных зонах лобной, теменной и височной долей у взрослых обезьян выявлено включение новых гранулярных нейронов с непродолжительным временем жизни — до двух недель. Данное явление объясняют участием этих зон в процессах обучения и памяти.
В пределах каждого полушария близлежащие и отдалённые области взаимодействуют между собой, но сенсорные области в пределах полушария не сообщаются друг с другом напрямую. Между собой связаны гомотопические, то есть симметричные, области разных полушарий. Полушария связаны также с нижележащими, эволюционно более древними подкорковыми областями мозга.
Резервы мозга
Впечатляющие свидетельства пластичности мозга нам доставляет неврология, особенно в последние годы, с появлением визуальных методов исследования мозга: компьютерной, магнитно-резонансной и позитронно-эмиссионной томографии, магнитоэнцефалографии. Полученные с их помощью изображения мозга позволили убедиться, что в некоторых случаях человек способен работать и учиться, быть социально и биологически полноценным, даже утратив весьма значительную часть мозга.
Пожалуй, наиболее парадоксальный пример пластичности мозга — случай гидроцефалии у математика, приведшей к утрате почти 95% коры и не повлиявшей на его высокие интеллектуальные способности. Журнал „Science“ опубликовал по этому поводу статью с ироничным названием „Действительно ли нам нужен мозг?“.

Рис. 2. Ход двигательного (пирамидного) тракта от коры полушарий через ствол мозга и перекрёст его путей в продолговатом мозге:
1 — область внутренней капсулы,
2 — перекрёст толстых пучков пирамидных трактов.
|
Однако чаще значительное повреждение мозга ведёт к глубокой пожизненной инвалидности — его способность восстанавливать утраченные функции не беспредельна. Распространённые причины поражения мозга у взрослых — нарушения мозгового кровообращения (в наиболее тяжёлом проявлении — инсульт), реже — травмы и опухоли мозга, инфекции и интоксикации. У детей нередки случаи нарушения развития мозга, связанные как с генетическими факторами, так и с патологией внутриутробного развития.
Среди факторов, определяющих восстановительные способности мозга, прежде всего следует выделить возраст пациента. В отличие от взрослых, у детей после удалений одного из полушарий другое полушарие компенсирует функции удалённого, в том числе и языковые. (Хорошо известно, что у взрослых людей утрата функций одного из полушарий сопровождается нарушениями речи.) Не у всех детей компенсация происходит одинаково быстро и полно, однако треть детей в возрасте 1 года с парезом рук и ног к 7 годам избавляются от нарушений двигательной активности. До 90% детей с неврологическими нарушениями в неонатальном периоде впоследствии развиваются нормально. Следовательно, незрелый мозг лучше справляется с повреждениями.
Второй фактор — длительность воздействия повреждающего агента. Медленно растущая опухоль деформирует ближайшие к ней отделы мозга, но может достигать внушительных размеров, не нарушая функций мозга: в нём успевают включиться компенсаторные механизмы. Однако острое нарушение такого же масштаба чаще всего бывает несовместимо с жизнью.
Третий фактор — локализация повреждения мозга. Небольшое по размеру, повреждение может затронуть область плотного скопления нервных волокон, идущих к различным отделам организма, и стать причиной тяжкого недуга. К примеру, через небольшие участки мозга, именуемые внутренними капсулами (их две, по одной в каждом полушарии), от мотонейронов коры мозга проходят волокна так называемого пирамидного тракта (рис. 2), идущего в спинной мозг и передающего команды для всех мышц туловища и конечностей. Так вот, кровоизлияние в области внутренней капсулы может привести к параличу мышц всей половины тела.
Четвёртый фактор — обширность поражения. В целом чем больше очаг поражения, тем больше выпадений функций мозга. А поскольку основу структурной организации мозга составляет сеть из нейронов, выпадение одного участка сети может затронуть работу других, удалённых участков. Вот почему нарушения речи нередко отмечаются при поражении областей мозга, расположенных далеко от специализированных областей речи, например центра Брока (поля 44–45 на рис. 1).
Наконец, помимо этих четырёх факторов, важны индивидуальные вариации в анатомических и функциональных связях мозга.
Как реорганизуется кора
Мы уже говорили о том, что функциональная специализация разных областей коры мозга определяется их архитектурой. Эта сложившаяся в эволюции специализация служит одним из барьеров для проявления пластичности мозга. Например, при повреждении первичной моторной коры у взрослого человека её функции не могут взять на себя сенсорные области, расположенные с ней по соседству, но прилежащая к ней премоторная зона того же полушария — может.
У правшей при нарушении в левом полушарии центра Брока, связанного с речью, активируются не только прилежащие к нему области, но и гомотопическая центру Брока область в правом полушарии. Однако такой сдвиг функций из одного полушария в другое не проходит бесследно: перегрузка участка коры, помогающего повреждённому участку, приводит к ухудшению выполнения его собственных задач. В описанном случае передача речевых функций правому полушарию сопровождается ослаблением у пациента пространственно-зрительного внимания — например, такой человек может частично игнорировать (не воспринимать) левую часть пространства.
Примечательно, что межполушарная передача функций в одних случаях возможна, а в других — нет. По-видимому, это означает, что гомотопические зоны в обоих полушариях загружены неодинаково. Возможно, поэтому при лечении инсульта методом транскраниальной микроэлектростимуляции (подробнее о ней мы расскажем далее) чаще наблюдается и успешнее протекает улучшение речи, чем восстановление двигательной активности руки.
Компенсаторное восстановление функции, как правило, происходит не за счёт какого-либо одного механизма. Практически каждая функция мозга реализуется с участием различных его областей, как корковых, так и подкорковых. Например, в регуляции двигательной активности помимо первичной моторной коры принимают участие ещё несколько дополнительных моторных корковых центров, которые имеют собственные связи с ближними и отдалёнными областями мозга и собственные пути, идущие через ствол головного мозга в спинной мозг. При повреждении первичной моторной коры активация этих центров улучшает двигательные функции.
Кроме того, организация самого пирамидного тракта — наиболее длинного проводящего пути, который состоит из многих миллионов аксонов („отводящих“ отростков) мотонейронов коры и следует к нейронам передних рогов спинного мозга (рис. 2), — предоставляет и другую возможность. В продолговатом мозге пирамидный тракт расщепляется на два пучка: толстый и тонкий. Толстые пучки перекрещиваются друг с другом, и в результате толстый пучок правого полушария в спинном мозге следует слева, а толстый пучок левого полушария — соответственно справа. Мотонейроны коры левого полушария иннервируют мышцы правой половины тела, и наоборот. Тонкие же пучки не перекрещиваются, ведут от правого полушария к правой стороне, от левого — к левой.
У взрослого человека активность мотонейронов коры, аксоны которых проходят по тонким пучкам, практически не выявляется. Однако при поражении, например, правого полушария, когда нарушается двигательная активность мышц шеи и туловища левой стороны, в левом полушарии активируются именно эти мотонейроны, с аксонами в тонком пучке. В результате активность мышц частично восстанавливается. Можно предположить, что этот механизм также задействован при лечении инсультов в острой стадии транскраниальной микроэлектростимуляцией.
Замечательное проявление пластичности мозга — реорганизация повреждённой коры даже по прошествии многих лет с момента возникновения повреждения. Американский исследователь Эдвард Тауб (ныне работающий в университете Алабамы) и его коллеги из Германии Вольфганг Митнер и Томас Элберт предложили простую схему реабилитации двигательной активности у пациентов, перенёсших инсульт. Давность перенесённого поражения мозга среди их пациентов варьировала от полугода до 17 лет. Суть двухнедельной терапии заключалась в разработке движений парализованной руки с помощью различных упражнений, причём здоровая рука была неподвижной (фиксировалась). Особенность этой терапии — интенсивность нагрузки: пациенты упражнялись по шесть часов ежедневно! Когда же мозг пациентов, у которых восстановилась двигательная активность руки, обследовали с помощью функциональной магнитно-резонансной томографии, то оказалось, что в выполнение движений этой рукой вовлекаются множество областей обоих полушарий. (В норме — при непоражённом мозге, — если человек двигает правой рукой, у него активируется преимущественно левое полушарие, а правое полушарие ответственно за движение левой руки.)
Восстановление активности парализованной руки через 17 лет после инсульта — бесспорно, волнующее достижение и яркий пример реорганизации коры. Однако реализовано это достижение высокой ценой — соучастием большого числа областей коры и притом обоих полушарий.
Принцип работы мозга таков, что в каждый момент та или иная область коры может участвовать только в одной функции. Вовлечение сразу многих областей коры в управление движениями руки ограничивает возможность параллельного (одновременного) выполнения мозгом разных задач. Представим себе ребёнка на двухколёсном велосипеде: он восседает на седле, крутит ногами педали, прослеживает свой маршрут, правой рукой фиксирует руль и её указательным пальцем нажимает на звонок, а левой рукой держит печенье, откусывая его. Выполнение такой простой программы быстрого переключения с одного действия на другое непосильно не только для поражённого, но и для реорганизованного мозга. Не умаляя важности предложенного метода реабилитации инсультных больных, хотелось бы заметить, что она не может быть совершенной. Идеальным вариантом представляется восстановление функции не за счёт реорганизации поражённого мозга, а за счёт его регенерации.
Отступление от правил
Обратимся теперь ко второму сценарию: мозг цел, но повреждены периферические органы, а конкретнее — слух или зрение. Именно в такой ситуации оказываются люди, рождённые слепыми или глухими. Давно замечено, что слепые быстрее дискриминируют слуховую информацию и воспринимают речь, чем зрячие. Когда слепых от рождения (и утративших зрение в раннем детстве) исследовали методом позитронно-эмисионной томографии мозга в то время, как они читали тексты, набранные брайлевским шрифтом, оказалось, что при чтении пальцами у них активируется не только соматосенсорная кора, ответственная за тактильную чувствительность, но и зрительная кора. Почему это происходит? Ведь в зрительную кору у слепых не поступает информация от зрительных рецепторов! Аналогичные результаты были получены при изучении мозга глухих: они воспринимали используемый ими для общения знаковый язык (жестикуляцию) в том числе и слуховой корой.
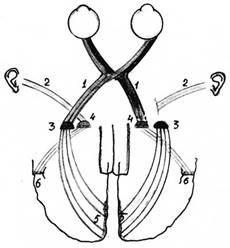
Рис. 3. Операция подсадки зрительного тракта к медиальному коленчатому телу таламуса. Слева показан нормальный ход нервных путей от глаз и ушей, справа — их расположение после операции. (Нервные пути, несущие слуховую информацию, отсекали от медиальных коленчатых тел и на их места подсаживали окончания зрительных нервов, отделённые от латеральных коленчатых тел таламуса. Было уничтожено также нижнее двухолмие в среднем мозге, где переключается часть нервных путей от уха в слуховую кору (не показано на схеме):
1 — зрительный тракт,
2 — слуховой тракт,
3 — латеральные коленчатые тела таламуса,
4 — медиальные коленчатые тела таламуса,
5 — таламокортикальные пути к зрительной коре,
6 — таламокортикальные пути к слуховой коре.
|
Как уже отмечалось, сенсорные зоны не связаны в коре напрямую друг с другом, а взаимодействуют лишь с ассоциативными областями. Можно предположить, что переадресация соматосенсорной информации у слепых в зрительную кору и зрительной информации у глухих — в слуховую происходит с участием подкорковых структур. Такая переадресация представляется экономичной. При передаче информации от сенсорного органа в сенсорную область коры сигнал несколько раз переключается с одного нейрона на другой в подкорковых образованиях мозга. Одно из таких переключений происходит в таламусе (зрительном бугре) промежуточного мозга. Пункты же переключения нервных путей от разных сенсорных органов близко соседствуют (рис. 3, слева).
При повреждении какого-либо сенсорного органа (или идущего от него нервного пути) его пункт переключения оккупируют нервные пути другого сенсорного органа. Поэтому сенсорные области коры, оказавшиеся отрезанными от обычных источников информации, вовлекаются в работу за счёт переадресации им иной информации. Но что происходит тогда с самими нейронами сенсорной коры, обрабатывающими чужую для них информацию?
Исследователи из Массачусетсского технологического института в США Джитендра Шарма, Алессандра Ангелуччи и Мриганка Сур брали хорьков в возрасте одного дня и делали зверькам хирургическую операцию: подсаживали оба зрительных нерва к таламокортикальным путям, ведущим в слуховую сенсорную кору (рис. 3). Целью эксперимента было выяснить, преобразуется ли слуховая кора структурно и функционально при передаче ей зрительной информации. (Напомним ещё раз, что для каждого типа коры характерна особая архитектура нейронов.) И в самом деле, это произошло: слуховая кора морфологически и функционально стала похожа на зрительную!
Иначе поступили исследователи Дайана Канн и Ли Крубитцер из Калифорнийского университета. Опоссумам на четвёртый день после рождения удалили оба глаза и через 8–12 месяцев у повзрослевших животных изучали первичные сенсорные области коры и прилегающую к ним ассоциативную зону. Как и ожидалось, у всех ослеплённых животных реорганизовалась зрительная кора: она сильно уменьшилась в размере. Зато, к удивлению исследователей, непосредственно к зрительной коре прилегала структурно новая область X. Как зрительная кора, так и область X содержали нейроны, воспринимавшие слуховую, соматосенсорную или и ту и другую информацию. В зрительной коре оставалось ничтожное число участков, не воспринимавших ни ту, ни другую сенсорную модальность — то есть сохранивших, вероятно, своё первоначальное назначение: восприятие зрительной информации.
Неожиданным оказалось то, что реорганизация коры затронула не только зрительную кору, но и соматосенсорную, и слуховую. У одного из животных соматосенсорная кора содержала нейроны, реагировавшие или на слуховую, или на соматосенсорную, или на обе модальности, а нейроны слуховой коры реагировали либо на слуховые сигналы, либо на слуховые и соматосенсорные. При нормальном развитии мозга такое смешение сенсорных модальностей отмечается только в ассоциативных областях более высокого порядка, но не в первичных сенсорных областях.
Развитие мозга определяется двумя факторами: внутренним — генетической программой и внешним — информацией, поступающей извне. Вплоть до последнего времени оценка влияния внешнего фактора была трудноразрешимой экспериментальной задачей. Исследования, о которых мы только что рассказали, позволили установить, насколько важен характер поступающей в мозг информации для структурно-функционального становления коры. Они углубили наши представления о пластичности мозга.
Почему мозг регенерирует плохо
Цель регенерационной биологии и медицины — при повреждении органа блокировать заживление рубцеванием и выявить возможности перепрограммирования повреждённого органа на восстановление структуры и функции. Эта задача предполагает восстановление в повреждённом органе состояния, характерного для эмбриогенеза, и присутствие в нём так называемых стволовых клеток, способных размножаться и дифференцироваться в различные типы клеток.
В тканях взрослого организма клетки часто обладают весьма ограниченной способностью к делению и жёстко придерживаются „специализации“: клетки эпителия не могут превращаться в клетки мышечного волокна и наоборот. Однако накопившиеся к настоящему времени данные позволяют с уверенностью утверждать, что практически во всех органах млекопитающих клетки обновляются. Но скорость обновления различна. Регенерация клеток крови и эпителия кишечника, рост волос и ногтей идут в постоянном темпе на протяжении всей жизни человека. Замечательной регенерационной способностью обладают печень, кожа или кости, причём регенерация требует участия большого числа регуляторных молекул различного происхождения. Иначе говоря, гомеостаз (равновесие) этих органов находится под системным надзором, так что их способность к регенерации пробуждается каждый раз, когда какое-либо повреждение нарушает равновесие.
Обновляются, хоть и медленно, мышечные клетки сердца: нетрудно подсчитать, что за время человеческой жизни клеточный состав сердца хотя бы раз обновляется полностью. Более того, обнаружена линия мышей, у которых практически полностью регенерирует сердце, поражённое инфарктом. Каковы же перспективы регенерационной терапии мозга?
Нейроны обновляются и в мозгу взрослого человека. В обонятельных луковицах мозга и зубчатой извилине гиппокампа, расположенного на внутренней поверхности височной доли мозга, идёт непрерывное обновление нейронов. Из мозга взрослого человека выделены стволовые клетки, и в лабораторных условиях показано, что они могут дифференцироваться в клетки других органов. Как уже упоминалось, в ассоциативных областях лобной, височной и теменной долей у взрослых обезьян образуются новые гранулярные нейроны с небольшим (около двух недель) временем жизни. У приматов также выявлен нейроногенез в обширной области, охватывающей внутреннюю и нижнюю поверхности височной доли мозга. Но эти процессы имеют ограниченный характер — иначе они вошли бы в противоречие с эволюционно сформировавшимися механизмами мозга.
Трудно представить, как человек и его младшие братья существовали бы в природе при быстром клеточном обновлении мозга. Невозможно было бы сохранять в памяти накопленный опыт, информацию об окружающем мире, необходимые навыки. Более того, оказались бы невозможными механизмы, отвечающие за комбинаторное манипулирование мысленными представлениями об объектах и процессах прошлого, настоящего или будущего — всё то, что лежит в основе сознания, мышления, памяти, языка и др.
Исследователи сходятся в том, что ограниченность регенерации взрослого мозга нельзя объяснить каким-либо одним фактором и потому нельзя снять каким-то единичным воздействием. Сегодня известно несколько десятков разных молекул, блокирующих (или индуцирующих) регенерацию длинных отростков нейронов — аксонов. Хотя уже достигнуты некоторые успехи в стимуляции роста повреждённых аксонов, до решения проблемы регенерации самих нейронов ещё далеко. Однако в наши дни, когда сложность мозга перестала отпугивать исследователей, эта проблема всё больше привлекает внимание. Но мы не должны забывать про то, о чём говорилось в предыдущем абзаце. Восстановление повреждённого мозга не будет означать полного восстановления прежней личности: гибель нейронов — это невосполнимая утрата прошлого опыта и памяти.
Что такое МЭС
Сложность механизмов регенерации мозга дала толчок поискам таких системных воздействий, которые вызывали бы движение молекул в самих нейронах и в их окружении, переводя мозг в новое состояние. Синергетика — наука о коллективных взаимодействиях — утверждает, что новое состояние в системе можно создать перемешиванием её элементов. Поскольку большинство молекул в живых организмах несёт заряд, подобное возмущение в мозгу можно было бы вызвать с помощью внешних слабых импульсных токов, приближающихся по своим характеристикам к биотокам самого мозга. Эту идею мы и попытались осуществить на практике.
Решающим фактором для нас стала медленноволновая (0,5–6 герц) биоактивность мозга маленьких детей. Поскольку на каждой стадии развития характеристики мозга самосогласованны, мы выдвинули допущение, что именно эта активность поддерживает способность детского мозга к восстановлению функций. Не сможет ли медленноволновая микро-электростимуляция слабыми токами (МЭС) индуцировать подобные механизмы у взрослого человека?
Разница в электрическом сопротивлении клеточных элементов и межклеточной жидкости нервной ткани громадна — у клеток оно в 10 3–10 4 раз выше. Поэтому при МЭС молекулярные сдвиги скорее произойдут в межклеточной жидкости и на поверхности клеток. Сценарий изменений может быть следующим: наиболее сильно начнут колебаться малые молекулы в межклеточной жидкости, низкомолекулярные регуляторные факторы, слабо связанные с клеточными рецепторами, оторвутся от них, изменятся потоки ионов из клеток и в клетку и т. д. Следовательно, МЭС может вызвать немедленную пертурбацию межклеточной среды в очаге поражения, изменить патологический гомеостаз и индуцировать переход к новым функциональным отношениям в ткани мозга. В результате клиническая картина заболевания быстро улучшится, уменьшится нейродефицит. Заметим, что процедура МЭС безвредна, безболезненна и непродолжительна: пациенту просто накладывают на определённые области головы пару электродов, подсоединённых к источнику тока.
Чтобы проверить, насколько справедливы наши предположения, мы в сотрудничестве со специалистами из нескольких клиник и больниц Санкт-Петербурга отобрали пациентов со следующими поражениями центральной нервной системы: острая стадия инсульта, невралгия тройничного нерва, опийный абстинентный синдром и детский церебральный паралич. Эти заболевания различаются по своему происхождению и механизмам развития, однако в каждом случае МЭС вызывала быстрые либо немедленные терапевтические эффекты (быстрый и немедленный — не одно и то же: немедленный эффект наступает сразу после после воздействия или же в очень скором времени). Наиболее важные из них приведены в таблице.
| Терапевтические эффекты МЭС |
| Болезнь |
Терапевтический эффект |
| Инсульт |
Релаксация, снотворный эффект, уменьшение нейродефицита — восстановление чувствительности, моторной и речевой активности |
| Детский церебральный паралич |
Снятие спастичности, ускорение психомоторного развития, улучшение речи, интеллекта и др. |
| Невралгия тройничного нерва |
Стойкое устранение пароксизмов боли |
| Опийный абстинентный синдром |
Анксиолитический, антидепрессивный, снотворный и седативный эффекты, подавление влечения к наркотику в различной степени |
Столь впечатляющие результаты дают основание полагать, что МЭС изменяет функционирование сетевой структуры мозга за счёт разных механизмов. Что касается быстрых и нарастающих от процедуры к процедуре эффектов МЭС у пациентов в острой стадии инсульта, то они, помимо механизмов, рассмотренных выше, могут быть связаны с восстановлением нейронов, подавленных интоксикацией, с предотвращением апоптоза — запрограммированной гибели нейронов в зоне поражения, а также с активированием регенерации. Последнее предположение подкрепляется тем, что МЭС ускоряет восстановление функции руки после того, как в ней хирургическим путём воссоединяют концы повреждённых периферических нервов, а также тем, что у пациентов в нашем исследовании наблюдались и отсроченные терапевтические эффекты.
При опийном абстинентном синдроме реализуется третий из рассматриваемых нами сценариев пластичности мозга. Это психическое расстройство, связанное с многократным приёмом наркотика. На начальных этапах нарушения ещё не сопряжены с заметными структурными изменениями мозга, как при детском церебральном параличе, но в значительной степени обусловлены процессами, происходящими на микроуровне. Быстрота и множественность эффектов МЭС при этом синдроме и при других психических расстройствах подтверждает наше предположение о том, что МЭС воздействует сразу на множество разных молекул.
Лечение с помощью МЭС получали в общей сложности более 300 пациентов, причём главным критерием для оценки действия МЭС служили терапевтические эффекты. В будущем нам представляется необходимым не столько выяснение механизма действия МЭС, сколько достижение максимальной пластичности мозга при каждом заболевании. Так или иначе, свести объяснение действия МЭС к каким-то отдельным молекулам либо клеточным сигнальным системам было бы, по-видимому, некорректно.
Важное достоинство микроэлектростимуляции слабыми токами — в том, что она, в отличие от популярных ныне методов заместительной клеточной и генной терапии, запускает эндогенные, собственные механизмы пластичности мозга. Главная проблема заместительной терапии даже не в том, чтобы накопить необходимую массу клеток для трансплантации и ввести их в поражённый орган, а в том, чтобы орган принял эти клетки, чтобы они смогли в нём жить и работать. До 97% клеток, трансплантированных в мозг, погибает! Поэтому дальнейшее изучение МЭС в индуцировании процессов регенерации мозга представляется перспективным.
Заключение
Мы рассмотрели лишь некоторые примеры пластичности мозга, связанные с восстановлением повреждений. Другие её проявления имеют отношение к развитию мозга, точнее, к механизмам, ответственным за память, обучение и другие процессы. Возможно, здесь нас ждут новые захватывающие открытия. (Вероятный предвестник их — неонейроногенез в ассоциативных зонах лобной, теменной и височной долей взрослых обезьян.)
Однако у пластичности мозга есть и отрицательные проявления. Её минус-эффекты определяют многие болезни мозга (например, болезни роста и старения, психические расстройства). Обзоры многочисленных данных по визуальным исследованиям мозга сходятся в том, что при шизофрении часто уменьшается кора фронтальной области. Но нередки также изменения коры и в других областях мозга. Следовательно, уменьшается число нейронов и контактов между нейронами поражённой области, а также число её связей с другими отделами мозга. Изменяется ли при этом характер переработки поступающей в них информации и содержание информации „на выходе“? Нарушения восприятия, мышления, поведения и языка у больных шизофренией позволяют утвердительно ответить на этот вопрос.
Мы видим, что механизмы, отвечающие за пластичность мозга, играют важнейшую роль в его функционировании: в компенсации повреждений и в развитии болезней, в процессах обучения и формирования памяти и др. Не будет большим преувеличением отнести пластичность к фундаментальным особенностям мозга.
|