| Андрогенез у рыб, или Только из мужского семени
Анна Семеновна Грунина, к.б.н., с.н.с. Института биологии развития им.Н.К.Кольцова РАН.
Александр Витальевич Рекубратский, к.б.н., с.н.с. Всероссийского НИИ пресноводного рыбного хозяйства.
В природе лишь немногие виды организмов размножаются за счет андрогенеза (от греч.: - мужчина, род. падеж ; - происхождение, рождающий). Это - форма размножения, при которой в развитии зародыша участвуют мужское ядро (привнесенное в яйцо сперматозоидом) и цитоплазма яйцеклетки. Таким способом размножаются отдельные виды животных (например, наездники Habrobracon) и некоторые растения (кукуруза, табаки) в том случае, если женское ядро погибает до оплодотворения (потому этот процесс у них в действительности ложный).
Андрогенез можно вызвать искусственно, механически удалив из яйца женское ядро или прибегнув к его инактивации физическими или химическими агентами. Зародыши, возникающие в результате “оплодотворения” * таких яйцеклеток, имеют гаплоидный (т.е. один) набор хромосом - мужских - и обычно нежизнеспособны.
* Здесь и далее слово берется в кавычки, чтобы отличить этот ложный процесс от истинного оплодотворения - слияния женского ядра с мужским.
Чтобы получить андрогенетическое жизнеспособное потомство, необходимо вызвать удвоение (диплоидизацию) мужского хромосомного комплекса и тем самым компенсировать недостающие женские хромосомы. Диплоидизация может быть достигнута двумя способами. Один из них - блокирование первого деления дробления “оплодотворенного” яйца, за счет чего оно становится диплоидным. Второй способ - слияние ядер спермиев при полиспермном оплодотворении. Если яйцеклетки принадлежат одному виду, а спермии - другому, андрогенез будет межвидовым, а потомство гибридным. И гибриды эти не обычные, а андрогенетические ядерно-цитоплазматические, т.е. произошедшие от отцовского ядра и материнской цитоплазмы.
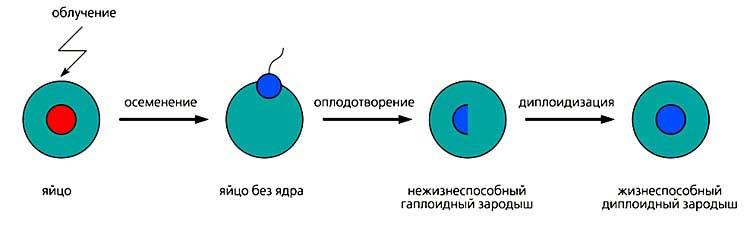
Схема индуцированного диплоидного андрогенеза.
На стадии осеменения женское ядро, инактивированное облучением, отдельно не показано.
Искусственный, или, как говорят специалисты, индуцированный, андрогенез используется для решения многих задач, таких как получение высокоинбредных линий (выведенных длительным инбридингом - близкородственным скрещиванием) и клонов, регуляция пола, изучение взаимоотношений между ядром и цитоплазмой и т.д. В последнее время индуцированный андрогенез привлекает все больше внимания в связи с проблемой сохранения редких и исчезающих видов только из генетического материала спермиев [1, 2]. Привлекательность такого подхода в существенной мере определяется тем, что технология криоконсервации спермы уже в основном разработана. Задача же длительного хранения яйцеклеток и зародышей многих животных пока не решена [3].
Здесь мы расскажем о результатах наших исследований по индуцированному андрогенезу у рыб, главным образом осетровых. Эти одни из древнейших рыб - деликатесная пища человека, ценнейший источник животного белка. Однако зарегулированием стока рек, их сильной загрязненностью, переловом и браконьерством запасы осетровых в значительной мере подорваны, а отдельные популяции и виды близки к исчезновению [4]. К сожалению, не исключение в этом и Россия, хотя численность осетровых рыб в нашей стране была наибольшей, а генофонд - уникальным.
Два метода
Мы занялись индуцированным диплоидным андрогенезом у рыб в 1989 г. Основателем же таких исследований был А.А.Нейфах, под руководством которого они были начаты в лаборатории биохимической эмбриологии Института биологии развития им.Н.К.Кольцова. Наши работы стали логическим продолжением исследований по радиационной инактивации ядер и изучению ядерно-цитоплазматической несовместимости у андрогенетических гаплоидных гибридов рыб.
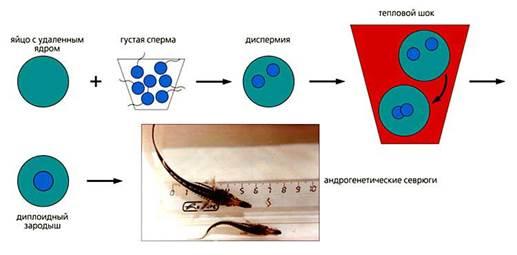
Схема диспермного андрогенеза у осетровых рыб.
Сначала мы разработали метод диплоидного андрогенеза: ядра яйцеклеток инактивировали ионизирующим излучением, а чтобы удвоить мужской хромосомный набор, тепловым шоком блокировали первое деление дробления. Так удалось получить жизнеспособные андрогенетические потомства нескольких видов костистых рыб [2]. Однако с осетровыми мы не добились успеха, так как их личинки погибали еще до перехода к активному питанию. Видимо, высокий уровень гомозиготности *, возникающий в результате блокирования первого деления дробления, снижает жизнеспособность зародышей этих рыб [2].
* Гомозиготность - наличие одинаковых аллелей (форм) одного гена в гомологичных хромосомах.
Чтобы преодолеть гомозиготность, мы начали исследования по диспермному андрогенезу. Этот метод тоже ведет к восстановлению диплоидности зародышей - за счет слияния хромосомных наборов двух спермиев. В результате возникает гетерозиготное * потомство с обычным уровнем генетической изменчивости.
* У гетерозиготных особей в гомологичных хромосомах имеются разные аллели одного и того же гена
Надо сказать, что благодаря своим биологическим особенностям осетры представляют собой чрезвычайно удобный объект для исследований по диспермному андрогенезу. Так, яйцеклетки осетровых рыб имеют несколько микропиле * (обычно 6-8), что позволяет в экспериментальных условиях, варьируя концентрацию спермиев (т.е. изменяя степень разведения спермы водой), добиться одновременного проникновения в каждую яйцеклетку двух или более спермиев. Кроме того, в яйцеклетках осетровых рыб отсутствуют механизмы **, которые блокировали бы проникновение сверхчисленных спермиев, поэтому они могут беспрепятственно включаться в развитие [5]. Указанные особенности яйцеклеток осетровых объясняются их приспособленностью к природным условиям: оплодотворение происходит на участках рек с довольно быстрым течением, и наличие нескольких микропиле повышает вероятность проникновения спермия в яйцо.
* Микропиле - отверстие в оболочке яйцеклетки у некоторых видов, предназначенное для проникновения в них спермия.
** Такие механизмы имеются в яйцеклетках некоторых животных (например, у морского ежа, ксенопуса), для которых полиспермное осеменение - норма. Действие этих механизмов обеспечивает участие в развитии организма только одного спермия.
Разработанный нами метод диспермного андрогенеза включает генетическую инактивацию яйцеклеток ионизирующим излучением; их осеменение концентрированной спермой; тепловой шок вскоре после осеменения для слияния ядер спермиев. Своим методом мы получили жизнеспособные андрогенетические потомства нескольких видов осетровых: сибирского и русского осетров, севрюги, белуги и др. [6]. Это первый случай успешного внутривидового андрогенеза у таких рыб.
Андрогенетические гибриды
Основная часть наших опытов была выполнена на экспериментальной базе Краснодарского НИИ рыбного хозяйства, где нам оказали содействие М.С.Чебанов и Ю.Н.Чмырь.
Мы упоминали уже, что андрогенез привлекает исследователей возможностью получать жизнеспособных особей редких и исчезающих видов. Для этой цели можно использовать межвидовой андрогенез: сохраненной (криоконсервированной) спермой, скажем, исчезающего вида “оплодотворить” яйцеклетки (с “убитыми” ядрами) близкого вида, а затем удвоить набор мужских хромосом. Результатом будут андрогенетические ядерно-цитоплазматические гибриды. Их ядерная ДНК принадлежит отцовскому виду, а митохондриальная - материнскому. Необходимость использовать в андрогенезе яйцеклетки “чужого” вида служит известным ограничением данного метода. Однако нужно учитывать, что по сравнению с ядерным геномом вклад митохондриальных генов в развитие организма невелик.

Белуга, севрюга и андрогенетический гибрид севрюга белуга.
Для сравнения все они сфотографированы в 10-месячном возрасте.
На жизнеспособности андрогенетических гибридов часто отрицательно сказывается ядерно-цитоплазматическая несовместимость, поскольку нарушаются нормальные взаимодействия между чужеродными друг другу ядром и цитоплазмой [2, 7]. Поэтому, чтобы получить андрогенетических гибридов, необходимо было избежать действия этого фактора.
Мы снова применили уже зарекомендовавший себя в предыдущих опытах метод диспермного андрогенеза. Но теперь родительские пары для “скрещивания” составляли из двух разных видов осетровых рыб (табл.1). Были испытаны комбинации видов как диплоидных, т.е. с относительно малым числом хромосом (около 120), так и тетраплоидных, многохромосомных (240-250 хромосом).

Если родители отличались количеством хромосом, во всех вариантах “скрещиваний” погибали и гаплоидные, и диплоидные гибриды на эмбриональных или ранних постэмбриональных стадиях. Объяснение этому мы увидели в том, что степень ядерно-цитоплазматической несовместимости может зависеть от двух причин: от филогенетической удаленности видов (что очевидно) и от различия в уровне плоидности (количестве гомологичных наборов хромосом) родительских видов [8]. Следовательно, для получения жизнеспособного андрогенетического гибридного потомства больше шансов на успех будет иметь комбинация видов с одинаковым уровнем плоидности. Иначе говоря, следует “скрещивать” между собой или диплоидный вид с диплоидным, или тетраплоидный с тетраплоидным.
Этот вывод подтвердился в дальнейших исследованиях. В тех опытах, в которых использовались яйцеклетки севрюги (Acipenser stellatus) и спермии белуги (Huso huso), мы получили жизнеспособных андрогенетических ядерно-цитоплазматических гибридов. Они живы до сих пор, сейчас им уже шесть лет. Нелишне отметить, что такие гибриды были получены впервые не только для рыб, но и вообще для позвоночных животных. Раньше, еще в 1950-х годах, Б.Л.Астауров вывел андрогенетических гибридов, но не позвоночных, а насекомых - шелкопряда [9].
Чтобы подтвердить наследование гибридами ядерной ДНК от отцовского вида, а митохондриальной от материнского, В.А.Барминцевым с сотрудниками (сектор молекулярной генетики гидробионтов, ВНИРО) был проведен молекулярно-генетический анализ. Как и должно быть, при осеменении севрюжьих яйцеклеток с “убитым” ядром спермой белуги у потомства ядерная ДНК принадлежала белуге, а митохондриальная ДНК, локализованная в цитоплазме и наследуемая по материнской линии, - севрюге. Кроме того, молекулярными методами был подтвержден и диспермный характер происхождения гибридов [6].
Мы получили жизнеспособных андрогенетических гибридов не только от родительской пары “севрюга белуга”, но и от других видов (с одинаковой плоидностью) осетровых рыб (см. табл.1). Для некоторых из этих гибридов Е.Д.Васильевой (биологический факультет МГУ) был выполнен детальный морфологический анализ. Судя по его результатам, к годовалому возрасту гибриды полностью идентичны по морфологическим признакам отцовскому виду [6].
В ходе экспериментов выяснилось, что не все пары видов с равным числом хромосом могут давать жизнеспособных гибридов. Так, на ранних стадиях останавливалось развитие зародышей от филогенетически близких севрюги и стерляди (A.ruthenus), белуги и шипа (A.nudiventris). Значит, помимо различий в плоидности существуют и другие, пока еще не изученные факторы несовместимости.
Преодолеть ядерно-цитоплазматическую несовместимость мы попытались обходным путем: для андрогенеза использовали яйцеклетки не чистых видов, а обычных межвидовых гибридов и сперму одного из родительских видов [10].
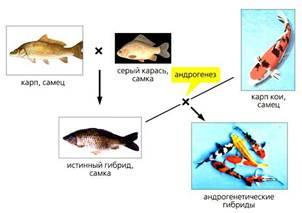
Схема получения андрогенетических межвидовых гибридов с применением гибридной цитоплазмы.
В опыте использованы цветные самцы карпа кои, маркированные рецессивными генами окраски, и серые самки дикого типа, доминантные по соответствующему признаку. Проявление у потомства окрашивания по отцовскому типу надежно подтверждает инактивацию женских ядер и индукцию андрогенетического развития.
Эффективность такого способа мы проверили в экспериментах на костистых рыбах. Оплодотворив спермиями карпа генетически инактивированные яйцеклетки гибридов от скрещивания серебряного карася с карпом и удвоив мужской хромосомный набор (блокированием первого деления дробления), получили жизнеспособных андрогенетических гибридов [10]. Возникшие из гибридных яйцеклеток, они развивались нормально, поскольку отцовское ядро попало в цитоплазму, наполовину состоящую из белков собственного вида. Кстати отметим: прямые андрогенетические гибриды от “скрещивания” облученных яйцеклеток серебряного карася и спермиев карпа, были нежизнеспособны [2].
Все тот же обходной маневр проверен нами и на осетровых рыбах: белуге, стерляди и их плодовитом гибриде - бестере. Но теперь использовались не гибридные яйцеклетки, а гибридная сперма. Надо сказать, из своих опытов мы уже знали, что от “скрещивания” стерляди с белугой выживаемость андрогенетических межвидовых гибридов на эмбриональных стадиях ниже, чем у эмбрионов от внутривидового андрогенеза у стерляди. Когда вместо спермиев белуги использовались спермии бестера, выживаемость андрогенетических зародышей значительно повысилась.
С криоконсервированной спермой
Научившись получать андрогенетических гибридов за счет слияния нативных спермиев, мы попытались использовать вместо них криоконсервированную сперму * [11]. Сложность была в том, что такая сперма обычно уже наполовину разведена растворами криозащитных сред, а наш метод диспермного андрогенеза требует концентрированной спермы. Кроме того, спермии после замораживания и последующего оттаивания могут терять подвижность, из-за чего снижается их оплодотворяющая способность.
* В этой работе участвует также группа криобиологов под руководством Л.И.Цветковой (лаборатория криобиологии Всероссийского НИИ пресноводного рыбного хозяйства).
Тем не менее нам удалось модифицировать методику осеменения облученных яйцеклеток криоконсервированной спермой и осуществить диспермный андрогенез у севрюги (табл.2). Правда, и оплодотворяющая способность замороженной спермы, и выживаемость андрогенетических зародышей оказались ниже, чем в вариантах с использованием нативной спермы. Что касается выживаемости зародышей, то ее низкий уровень, видимо, обусловлен возникновением в спермиях доминантных и (или) рецессивных леталей вследствие заморозки. Мы проследили за развитием выживших андрогенетических севрюжек примерно до трехнедельного возраста и заметили, что их гибель снижалась по мере роста. Таким образом, из криоконсервированной спермы опытным путем был воссоздан генотип азовской севрюги, запасы которой в настоящее время подорваны.
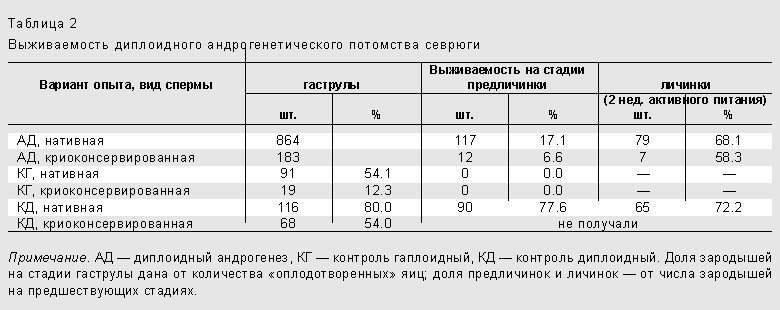
Итак, осуществлен диспермный андрогенез у осетровых рыб с использованием глубокозамороженной спермы. Это подтверждает пригодность метода для воссоздания геномов тех видов, от которых сохранилась только такая сперма.
С помощью андрогенеза с применением криоконсервированной спермы мы также оцениваем качество технологий ее замораживания [11]. С этой целью изучаем выживаемость гаплоидных зародышей. У них воспроизводится геном спермиев и проявляются все летальные и понижающие жизнеспособность мутации, которые могут быть замаскированы у диплоидов за счет работы второго генома. Сравнив выживаемость таких андрогенетических гаплоидов и тех, что развиваются при осеменении инактивированной икры нативной спермой, можно понять, насколько поврежден генетический аппарат спермиев под действием заморозки.
Половой состав потомства
Коль скоро речь идет об андрогенезе для воссоздания геномов редких и исчезающих видов осетровых рыб, естествен вопрос о половом составе потомства. Если оно состоит из самок и самцов, это обеспечит воспроизводство вида в ряду поколений обычным половым путем.
Каким же может быть половой состав потомков, получаемых с помощью диспермного андрогенеза? Ответ совсем непрост. Если пол у осетровых рыб определяется половыми хромосомами, состав андрогенетического потомства будет зависеть от того, гетеро- или гомогаметны самцы. При мужской гетерогаметности (генотип самцов XY, самок - XХ) за счет диспермного андрогенеза (слияния ядер двух спермиев) должны появиться самки XX и самцы XY и YY в соотношении 1:2:1. При мужской гомогаметности (генотип самцов ZZ, самок - ZW) андрогенетическое потомство будет состоять только из самцов ZZ, а для получения самок потребуется дополнительная процедура по гормональному переопределению пола.
* Гетерогаметный пол производит два или более типов гамет (половых клеток - спермиев, яйцеклеток) с разными половыми хромосомами, например X и Y или W и Z. - Примеч. ред.
Отметим: у осетровых рыб количество хромосом, причем мелких, довольно велико - у диплоидных видов 120, у тетраплоидных примерно 250 (для сравнения: у человека - 46). Поэтому прямая идентификация половых хромосом невозможна [12]. В этой ситуации изучать механизм определения пола можно косвенным путем - исследуя половой состав гиногенетического потомства, т.е. с исключительно материнской наследственностью. К настоящему времени известны всего две такие работы, выполненные на веслоносе (Polyodon spatula) и американском белом осетре (A.transmontanus) [13, 14]. В первой работе был сделан вывод о мужской гетерогаметности исследуемого вида, во второй - высказано предположение о женской гетерогаметности. Учитывая эти результаты, нельзя исключить, что пол у разных видов осетровых рыб может определяться разными системами, как, скажем, у тиляпий [15]. У рыб вообще пол может меняться даже в зависимости от условий окружающей среды, например от температуры. Поэтому делать окончательные выводы о механизме определения пола у осетровых рыб, основываясь на результатах изучения только гиногенетических потомств двух видов, по крайней мере преждевременно. Надежнее было бы использовать для этого также потомков с чисто отцовской наследственностью.
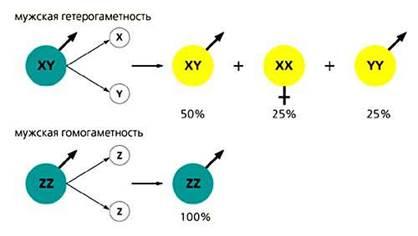
Соотношение полов в андрогенетическом потомстве в зависимости от механизма определения пола.
Мы изучаем механизм определения пола осетровых, исследуя (впервые) оба потомства - и андрогенетическое, и гиногенетическое. С помощью мейотического гиногенеза, для индукции которого инактивируем ядра сперматозоидов УФ-облучением и тепловым шоком подавляем второе деление мейоза в икре, уже получили жизнеспособных диплоидных гиногенетических потомков русского осетра и севрюги [6]. Мы полагаем, что, независимо от того, какой пол у осетровых гетерогаметный, заключение о механизме определения будет достаточно надежным, если сравнить гиногенетических и андрогенетических потомков одних и тех же видов.
* * *
Итак, мы разработали два метода диплоидного андрогенеза у рыб, первыми получили жизнеспособные андрогенетические потомства нескольких видов осетровых, а также ядерно-цитоплазматических гибридов. Достигли успеха в преодолении несовместимости ядра с цитоплазмой у таких гибридов и в использовании криоконсервированной спермы для диспермного андрогенеза. Многие направления исследования, в частности изучение механизма определения пола осетровых рыб, фактически только начаты. Но уже сегодня ясно, что метод диспермного андрогенеза может использоваться для восстановления и сохранения генофондов редких и исчезающих видов осетровых рыб.
Работа поддержана Российским фондом фундаментальных исследований (проект 06-04-49637) и подпрограммой “Биоразнообразие” Президиума РАН (проект № 6.1.9).
Список литературы
1. Veprintsev B.N., Rott N.N. // Nature. 1979. V.280. P.633-634.
2. Grunina A.S., Neyfakh A.A. // Physiol. Gen. Biol. Rev. 1997. V.12. P.73-103.
3. Corley-Smith G.E., Brandhorst B.P. // Mol. Reprod. Devel. 1999. V.53. P.363-367.
4. Birstein V.J., Hanner R., Salle R.de // Sturgeon Biodiversity and Conservation / Eds V.J.Birstein et al. Dordrecht, 1997. P.427-444.
5. Гинзбург А.С. Оплодотворение у рыб и проблема полиспермии. М., 1968.
6. Грунина А.С., Рекубратский А.В. // Онтогенез. 2005. Т.36. №.3. С.256-266.
7. Нейфах А.А., Радзиевская В.В. // Генетика. 1967. №12. С.80-88.
8. Рекубратский А.В., Грунина А.С., Мюге Н.С., Нейфах А.А. // Онтогенез. 1998. Т.29. №4. С. 394-400.
9. Астауров Б.Л., Острякова-Варшавер В.П. // Изв. АН СССР. Сер. биол. 1957. №2. С.154-175.
10. Рекубратский А.В., Грунина А.С. // Онтогенез. 2001. Т.32. №5. С.360-366.
11. Grunina A.S., Recoubratsky A.V., Tsvetkova L.I., Barmintsev V.A. // Int. J. Refrigeration. 2006. V.29. №3. P.379-386.
12. Васильев В.П. Эволюционная кариология рыб. М., 1985.
13. Mims S.D., Shelton W.L., Linhart O., Wang C. // J. World Aquacult. Soc. 1997. V.28. №4. P.334-343.
14. Eenennaam A.L.van, Eenennaam J.P.van, Medrano J.F., Doroshov S.I. // J. Hered. 1999. V.90. P.231-233.
15. Devlin R.H., Nagahama Y. // Aquaculture. 2002. V.208. P.191-364.
|