В.В.Девяткин
Германаты неодима типа Nd2 GeO5 и Nd 2Ge 2 O 7 получают по обычной керамической технологии или гидротермальным способом [1]. В последние годы получил развитие синтез указанных соединений в мягких условиях, с использованием в качестве растворителей водных и органических сред. Синтез осуществляется препаративными методами [2,3], не позволяющими наиболее полно изучить условия получения германатов определённого состава.
С целью изучения условий синтеза германатов неодима в неводных растворителях исследовано взаимодействие между компонентами системы NdCl3 – K2GeO3 – C2H5OH методом остаточных концентраций при 250С. В качестве исходных веществ использованы хлорид неодима “х.ч.” и синтезированный из GeO2 “ч.д.а.” и KOH по методике [4] метагерманат калия. При составлении смесей были взяты раствор NdCl3 в этаноле с концентрацией 3,9120 . 10-2 моль/л и раствор K2 GeО3 в этаноле с концентрацией 6,6152 . 10-2 моль/л. В реакционные сосуды вводился рассчитанный объём раствора K2 GeO3 и к нему добавлялся возрастающий объём раствора NdCl3 так, что отношение n(NdCl3) / n(K2GeО3 ) ( n) изменялось от 0,09 до 2,45. Растворы разбавлялись до 50 мл и перемешивались в течение 14 суток до установления равновесия. Жидкие и твёрдые фазы отделялись и анализировались на содержание ионов неодима (III) титрованием трилоном Б с ксиленоловым оранжевым в присутствии уротропинового буфера [5]. Cодержание ионов германия (IV) определялось гравиметрическим осаждением германомолибдата 8-оксихинолина [6,7]. Показатели активности ионов водорода p(aH+) регистрировались на pH-метре pH-150. Электропроводность (k) равновесных насыщенных растворов измерялась с помощью реохордного моста P-38.
Результаты и их обсуждение. Ранее проведённые исследования [8] показали возможность использования неводных сред для получения растворов хлорида неодима (III) определённой концентрации, зависящей от физико-химических характеристик растворителя и растворяемого вещества. Проведённый нами анализ растворимости K2 GeО3 в C2H5OH при 250 С показал значение 22,84 масс. %, соответственно растворимость NdCl3 в С2Н5ОН составила 0,74 масс. %. Безводный хлорид неодима, как и любой сильный электролит, в данном случае имеет небольшую растворимость, которая увеличивается в зависимости от содержания в растворе воды. Малая энергия активации и небольшая сила кислоты-катиона Nd3+ в сравнении с К+ обусловливают меньшую растворимость NdCl3 в C2H5OH, в отличие от K2 GeO3 .
Использование протолитических растворителей (C2H5OH, ЭТГ, глицерин) способствует более сильной сольватации анионов GeO32– и Cl–, увеличению энергии связи с молекулами растворителя, в отличие от апротонных (ДМФА). Поэтому в воде или спиртах реакции образования германатов протекают в тысячи раз медленнее, чем в ДМФА [9], хотя растворимость исходных компонентов в первом случае больше [10].
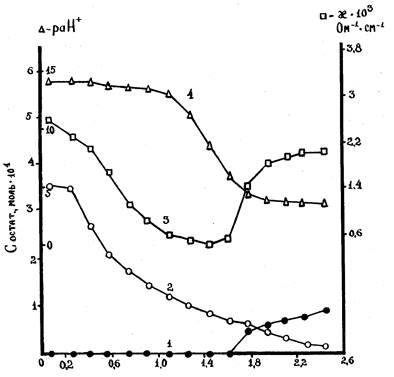
Проведённые исследования взаимодействий в системе NdCl3 – K2GeO3 – C2H5OH представлены в табл.1 и на рис.1. По мере увеличения отношения компонентов ( n) в исходных растворах от 0,09 до 2,45 остаточные концентрации германат-ионов уменьшаются от 3,55 . 10-4 до 0,12 . 10-4 моль/л. В интервале n < 1,61 ионы неодима (III) в равновесной жидкой фазе отсутствуют, так как полностью реагируют с германат-ионами (точки 1-10). Количества вступивших во взаимодействие компонентов указывают, что в щелочной среде (p(aH+) = 14,30 – 13,99) в интервале 0,26<n<0,59 простого соосаждения ионов не происходит, образуются равновесные твёрдые фазы постоянного состава. Соотношение неодима (III) и германия (IV) в твёрдой фазе равно 1 (точки 2-4). В интервале 1,78 < n < 2,28 реакция cреды кислая ( p(aH+) = 4,78-3,79), неодим также связывается в строгой стехиометрии с германат-ионами, в результате чего образуются твёрдые фазы с отношением указанных компонентов, равным 2 (точки 11-14). Полученные данные подтверждаются изменениями значений p(aH+) и электропроводности (k) растворов. В интервале 0,76 < n < 1,61 образуются твёрдые фазы переменного состава с избыточным содержанием неодима.
Полученные твёрдые фазы представляют собой мелкокристаллические вещества, интенсивность окраски которых изменяется от белого (сосуд № 1) до светло-фиолетового цвета (сосуд № 15) и зависит от соотношения исходных компонентов в растворе. Твёрдые фазы были отведены от жидких фаз, промыты спиртом и эфиром до отрицательного аналитического сигнала на ионы K+ (тетрафенилборат) и Сl– (нитрат серебра) [11]. Анализ спиртовой вытяжки с соотношением n > 2,28 показывает присутствие несвязанных ионов Nd3+, что свидетельcтвует о частичном соосаждении неодима (III) в указанном интервале. Анализ промытых и высушенных при 2500С твёрдых фаз указывает, что в интервале n<1,44 сохраняется отношение компонентов, равное 1. В интервале n > 1,78 соотношение равно 2. После прокаливания (5000С) промытых мелкодисперсных фаз и их химического анализа установлено, что состав твёрдых фаз соответствует соединениям Nd2 Ge 2O7 и Nd2GeO5 , представляющим собой мелкокристаллические вещества, не растворимые в воде.
Таблица 1
Результаты исследования системы NdCl3 – K2GeO3 – C2 H5OH
№
п/п
|
Взято Nd3+
моль . 104
|
Отношение
n (Nd3+) / n (Ge4+)
в исх. р-ре
|
Найдено в жидкой фазе моль . 104 |
Прореагировало
моль . 104
|
Отношение
n (Nd3+) / n (Ge4+)
в твёрдой фазе
|
Свойства жидкой фазы |
| Nd3+ |
Ge4+ |
Nd3+ |
Ge4+ |
p(аН+) |
k . 103 Ом-1 . см-1 |
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
|
0,39
1,18
1,96
2,74
3,52
4,3
5,09
5,87
6,65
7,43
8,22
9,00
9,78
10,56
11,35
|
0,09
0,26
0,42
0,59
0,76
0,92
1,1
1,27
1,44
1,61
1,78
1,95
2,11
2,28
2,45
|
—
—
—
—
—
—
—
—
—
—
0,49
0,58
0,71
0,79
0,93
|
3,55
3,45
2,67
2,06
1,77
1,45
1,22
1,05
0,81
0,71
0,6
0,42
0,33
0,18
0,12
|
0,39
1,18
1,96
2,74
3,52
4,3
5,09
5,87
6,65
7,43
7,73
8,42
9,07
9,77
10,42
|
1,08
1,18
1,96
2,57
2,86
3,18
3,41
3,58
3,79
3,92
4,03
4,21
4,3
4,45
4,51
|
0,36
1,00
1,00
1,07
1,23
1,35
1,49
1,64
1,76
1,90
1,92
2,00
2,11
2,20
2,31
|
14,34
14,30
14,17
13,99
13,86
13,59
13,47
11,23
8,97
6,04
4,78
4,11
3,98
3,89
3,79
|
2,57
2,29
2,05
1,70
1,14
0,83
0,60
0,50
0,47
0,53
1,43
1,87
1,98
2,01
2,10
|
Взято n (K2GeO3 ) = 4,6306 . 10-4 моль. Объём каждой смеси 50 мл.
| № |
Nd |
Ge |
| 1. |
Найдено, % : |
52,83 |
26,55 |
Вычислено для
Nd2Ge2O7, % :
|
52,87 |
26,61 |
| 2. |
Найдено, % : |
65,36 |
16,42 |
Вычислено для
Nd2 GeO5, % :
|
65,41 |
16,46 |
Отношение n (Nd3+) / n (Ge4+) в исходном растворе
Рис.1. Кривые остаточных концентраций ионов Nd3+ (1), Ge4+(2), электропроводность (3) и раН+ (4) жидких фаз.
Список литературы
Тананаев И.В., Шпирт М.Я. Химия германия. М.: Химия, 1967. С.146.
Тананаев И.В., Шпирт М.Я., Сендульская Т.И. // Докл. АН СССР. 1961. Т.139. С.907.
Зворыкин А.Я., Перельман Ф.М., Бабиевская И.З. // Журн.неорган.химии. 1960. Т.5. С.1717.
Schwarz R., Heinrich F.// Z.anorg. algem. Chem. 1932. B.43. S.205.
Шварценбах Г., Флашка Г. Комплексонометрическое титрирование. М.: Химия, 1970. С.249.
Назаренко В.А. Аналитическая химия германия. М.: Наука, 1973. С.103.
Алимарин И.П., Алексеева О.А. // Журн. прикл. химии. 1940. Т.13. С.1393.
Рунов Н.Н., Исаева Л.В. // Физико-химические исследования равновесий в растворах. Ярославль: ЯГПИ, 1983. Вып.202. С.26.
Фиалков Ю.Я. Растворитель как средство управления химическим процессом. Сер. “Химия”. М.: Знание, 1988. Вып.6. 48 с.
Химия редких и рассеянных элементов / Под ред. Большакова К.А. М.: Высшая школа, 1969. Т.1. С.176.
Резников А.А., Муликовская Е.П., Соколов И.Ю. Методы анализа природных вод. М.: Недра, 1970. 488 с.
|