Особенности организации нейроэндокринной системы
Daphnia magna (Cladocera)
В.В. Лидванов, Т.Г. Львова
Методом световой микроскопии при использовании цитоморфологических (окрашивание альдегид-функсином по Гомори-Габу) и функциональных критериев соответствия стадий клеточного цикла репродуктивному состоянию животных изучена ЦНС Daphnia magna (Cladocera, Crustacea).
Выявлены два типа нейронов, различающихся размерами, строением и тинкториальными свойствами. Гомори-положительные клетки II типа обладают секреторной активностью. Полифункциональность большинства нейронов ЦНС, отсутствие специализированных структур характеризует нейроэндокринную систему D. magna в качестве примитивной и соответствующей уровню организации аннелид.
Изучение строения и функционирования нейроэндокринной системы (НЭС), способов взаимодействия ее компонентов между собой, а также с отдельными элементами других функциональных систем организма является одним из основных направлений современных фундаментальных исследований. Значительные успехи уже достигнуты у позвоночных животных, тогда как у беспозвоночных эта система исследована недостаточно, а большинство работ посвящено высокоорганизованным представителям. Среди ракообразных эта система хорошо изучена у высших раков. Немногочисленные сведения, касающиеся представителей низших раков, свидетельствуют о наличии принципиальных отличий в строении их НЭС, что не позволяет проводить обобщений и требует дальнейших исследований в этой области.
Целью настоящей работы является исследование структурной организации НЭС D. magna. Помимо неизученности данного вида, выбор объекта исследования обусловлен еще и широким использованием его в эколого-физиологических и токсикологических экспериментах. В связи с этим полученные данные могут послужить основой для изучения роли НЭС в реакциях организма на изменение факторов окружающей среды.
Изучение НЭС D. magna проводили на серийных гистологических срезах толщиной 7 мкм, окрашенных альдегид-фуксином по Гомори-Габу и изготовленных из фиксированных в жидкости Буэна животных, находящихся на разных стадиях репродуктивного цикла (неполовозрелые самки размером 1,5 мм, половозрелые – размером 1,8 – 2,0 мм, самки размером 2,2 – 2,6 мм с яйцами, а также эмбрионами в выводковой камере, составившие I, II, III и IV группы соответственно).
Помимо характера окрашивания секреторная активность нейронов выявлялась на основании корреляции их секреторных циклов с физиологическим состоянием животных. С этой целью из 300 нейронов мозга в каждой из указанных групп подсчитывалось относительное количество клеток, находящихся на разных стадиях секреторного цикла.
Полученные результаты показали, что структурные элементы НЭС D. magna локализованы в ЦНС, которая представлена непарным оптическим ганглием, головным мозгом и брюшной нервной лестницей. Головной мозг располагается в клювовидном отростке под печеночными выростами и включает три отдела с соответствующим набором нейропилей, характерных для ракообразных. Тела нейронов распределены по поверхности: некоторые из них лежат одиночно, другие – концентрируются в группы (рис. 1).
На основании окрашивания альдегид-фуксином в ЦНС выделено два типа нейронов.
Нейроны I типа имеют округлую форму и небольшие размеры (d = 4,2 мкм; ядро – 2,7 мкм). Цитоплазма тонким слоем окружает ядро; Гомори-отрицательна. Нередко, однако, в перинуклеарной области выявляется узкое гомогенное Гомори-положительное кольцо, охватывающее ядро.
 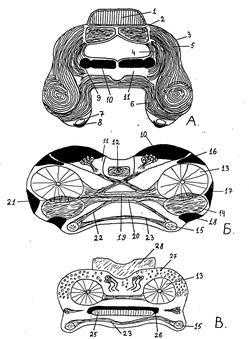
Рис. 1. Схема организации мозга D. magna с прилежащим оптическим ганглием:
а; б; в – дорсальная, центральная и вентральная
области мозга соответственно:
1, 2 – нейропили передней и задней долей оптического ганглия; 3 – оптический ствол;
терминально-оптический (4) и терминально-ольфакторно-акцессорный (5) тракты;
6 – тракты дейтоцеребрума, идущие в окологлоточную коннективу; 7 – нейропиль
антенн; 8 – группа нейронов нейропиля антенн; латеральная оптическая (9)
и медиальная оптическая (10) группы нейронов; 11 – оптический нейропиль;
12 – центральное тело; обонятельная (13) и добавочная (14) доли; 15 – нейропиль
антеннул; передняя латеральная (16), латеральная ольфакторно-акцессорная (17)
и латеральная акцессорная (18) группы нейронов; ольфакторно-ольфакторный (19),
акцессорно-акцессорный (20), ольфакторно-акцессорный (21), антеннулярно-
акцессорный (22), антеннулярно-антеннулярный (23) и оптико-ольфакторно-
акцессорный (24) тракты; 25 – центральный нейропиль; 26 – вентральная группа
нейронов центрального нейропиля; 27 – передняя вентральная группа
нейронов дейтоцеребрума; 28 – нижний край протоцеребрума;
группы НСК протоцеребрума (29) и дейтоцеребрума (30, 31)
 Нейроны II типа округлой или грушевидной формы, размером 5,0 ´ 3,5 мкм; ядро – 3,0 мкм и более. Их цитоплазма содержит материал, положительно окрашивающийся по Гомори, давая несколько вариантов окраски. Наблюдаемые от среза к срезу цитоморфологические и тинкториальные изменения нейронов этого типа в одних и тех же участках ЦНС свидетельствуют о том, что для них характерен секреторный цикл (рис. 2). Цитоплазма нейронов, находящихся на стадии накопления нейросекрета (I стадия), окрашена полностью и более или менее гомогенно, интенсивность окраски – самая высокая. В ходе этого процесса объем цитоплазмы увеличивается и клетка вытягивается. Появление небольшого числа светлых вакуолей по периферии клетки (II стадия) указывает на переход ее в стадию выведения нейросекрета, в течение которого количество вакуолей увеличивается и секреторный материал приобретает гранулярную структуру (III стадия). И в случае угасания секретообразования вакуоли сливаются, цитоплазма обычно пылевидно окрашивается лишь в перинуклеарной области и у аксонного холмика (IV стадия), выведение нейросекрета завершается. В общем, клетки III и IV стадии секреторного цикла, как правило, отличаются бóльшими размерами, более выраженной грушевидной формой перикариона и эксцентричным расположением ядра. Нейроны II типа округлой или грушевидной формы, размером 5,0 ´ 3,5 мкм; ядро – 3,0 мкм и более. Их цитоплазма содержит материал, положительно окрашивающийся по Гомори, давая несколько вариантов окраски. Наблюдаемые от среза к срезу цитоморфологические и тинкториальные изменения нейронов этого типа в одних и тех же участках ЦНС свидетельствуют о том, что для них характерен секреторный цикл (рис. 2). Цитоплазма нейронов, находящихся на стадии накопления нейросекрета (I стадия), окрашена полностью и более или менее гомогенно, интенсивность окраски – самая высокая. В ходе этого процесса объем цитоплазмы увеличивается и клетка вытягивается. Появление небольшого числа светлых вакуолей по периферии клетки (II стадия) указывает на переход ее в стадию выведения нейросекрета, в течение которого количество вакуолей увеличивается и секреторный материал приобретает гранулярную структуру (III стадия). И в случае угасания секретообразования вакуоли сливаются, цитоплазма обычно пылевидно окрашивается лишь в перинуклеарной области и у аксонного холмика (IV стадия), выведение нейросекрета завершается. В общем, клетки III и IV стадии секреторного цикла, как правило, отличаются бóльшими размерами, более выраженной грушевидной формой перикариона и эксцентричным расположением ядра.
Рис. 2. Стадии секреторного цикла нейросекреторных
клеток протоцеребрума D. magna:
I – накопление; II, III – выведение; IV – завершение выведения нейросекрета
Важным является тот факт, что грань между нейронами I и II типа довольно условна, поэтому в ходе своего функционирования одни способны превращаться в другие. Наблюдаемые морфологические изменения позволяют считать, что нейроны I типа не обладают секреторной активностью, но способны изменять свое функциональное состояние и приступать к синтезу нейросекрета, вступая в секреторный цикл, который ими же и замыкается при угасании специфического синтеза в секреторных нейронах.
Нейроны обоих типов равномерно распределены по отделам ЦНС. Однако количество нейронов II типа значительно больше нейронов I типа и составляет около 70 – 80 %. Кроме того, соотношение нейронов I и II типа изменяется в зависимости от стадии онтогенеза, и прежде всего от состояния репродуктивной системы (рис. 3). Так, в мозговом ганглии относительное количество клеток II типа изменяется от 62 (у неполовозрелых самок) до 80 % (у самок с эмбрионами в выводковой камере).

Рис. 3. Динамика секретирующих нейронов мозга
в пересчете на 300 клеток на разных стадиях онтогенеза D. magna
Таким образом, наличие секреторного цикла у Гомори-положительных нейронов ганглиев D. magna, а также взаимосвязь секреторной активности с состоянием репродуктивной системы позволяют сделать вывод об их способности к секреции. Эти данные не противоречат современным положениям нейронной теории [1]. В соответствии с ней каждый нейрон обладает несколькими группами регуляторных веществ, и поэтому, учитывая многообразие нейропептидов, неудивительно, что около 80 % нервных клеток ведут их синтез. То, что секреторно неактивные нейроны способны переключаться на синтез нейропептидов и превращаться в секреторные нейроны, указывает на их метаболическую пластичность и подтверждает одно из положений этой теории.
Несмотря на это, принимать подавляющее большинство Гомори–положительных нейронов D. magna за специализированные нейросекреторные клетки (НСК) нет никаких оснований, потому что, во-первых, они не образуют ни ограниченных областей выведения нейрогормона в гемолимфу, ни специализированных для этого структур, и, во-вторых, не формируют обособленные группы. Вероятнее всего, у организмов данного уровня организации ярко проявляется низкая специализация и связанная с ней полифункциональность нейронов, поэтому нейроны предпочтительнее обозначать секретирующими.
В мозговом ганглии среди них выделяются клетки, отличающиеся рядом морфологических особенностей и характером функционирования. Они обладают ярко выраженным секреторным циклом, на определенных стадиях которого имеют крупные размеры и хорошо выявляемые, часто широкие аксоны, набитые секреторным материалом. Такие клетки располагаются группами, образуемыми не только телами, но и их аксонами. Их морфология на разных стадиях секреторного цикла указывает на то, что основной путь выведения нейросекрета проходит через аксон. К сожалению, терминали аксонов обнаружить так и не удалось. Тем не менее указанное позволяет считать данные группы клеток более специализированными к процессам секреции, в связи с чем мы рассматриваем их как НСК.
В головном мозге выделено три парные группы НСК: одна принадлежит протоцеребруму, две другие – дейтоцеребруму (рис. 1).
В медиальной оптической группе нейронов протоцеребрума локализована группа из 5 – 7 НСК грушевидной формы с округлыми ядрами, функционирующими асинхронно. В зависимости от стадии секреторного цикла средние размеры их тел изменяются от 6,6 ´ 3,5 мк до 9,0 ´ 5,5 мк, ядер – от 3,1 до 4,3 мк соответственно. Секреторный материал на всех стадиях – гомогенный и не образует гранулярной структуры. Тела клеток плавно переходят в аксоны, которые сходятся в общий пучок. В его составе они движутся вдоль нейропилярного центрального тела, а затем расходятся, направляясь, по-видимому, к дорсальной поверхности мозга.
Следующая группа состоит из 3 – 4 НСК грушевидной формы и локализована в области латеральной акцессорной группы нейронов дейтоцеребрума. Тела клеток и их аксоны тесно примыкают друг к другу. Клетки функционируют синхронно, на стадии накопления средние размеры тел равны 6,4 ´ 4,5 мк, ядер – 3,4 мк, на последующих стадиях длина достигает 10 мк, ширина – 6,7 мк, а диаметр ядра – 4,2 мк. На стадии выведения секреторный материал имеет крупно-гранулярную структуру. Тела клеток без резких границ переходят в длинные и прямые аксоны, двигающиеся к медиальной линии мозга.
Третья парная группа, состоящая из 2 – 3 НСК, лежит в непарной передней вентральной группе нейронов дейтоцеребрума. Клетки имеют округлую форму и слегка овальное ядро. Функционируют синхронно, и в ходе секреторного цикла размеры их тел и ядер изменяются незначительно. Ярко выражена характерная для клеточного цикла трансформация секреторного материала, структура которого изменяется от гомогенного до гранулярного. Средний диаметр тел клеток равняется 7,2 мк, а ядер – 3,4 мк. Толщина аксонов на стадии выведения достигает 1,5 мк, на некотором расстоянии от тел клеток они делают резкий изгиб в горизонтальной плоскости и, по-видимому, направляются книзу.
Итак, полученные нами данные позволяют заключить, что центральные отделы НЭС D. magna образованы неспециализированными секретирующими нейронами и более специализированными группами НСК. Нейрогемальные структуры, обеспечивающие выброс нейрогормонов в гемолимфу, отсутствуют, и в частности центральный нейросекреторный комплекс Х-органа с синусной железой, характерный для высших раков, не сформирован.
Наши данные, касающиеся представленности периферических эндокринных желез, находящихся под нейрогуморальным контролем, очень ограничены. Установлено лишь, что в основании антенн располагаются образования, состоящие из 2 – 3 гигантских клеток. Характер окрашивания цитоплазмы (пенистый вид, крупно-гранулярные включения) указывает на их секреторную функцию и позволяет предположить, что это – Y-орган.
Анализируя имеющиеся в научной литературе и собственные данные, можно сделать вывод о сходстве структурной организации НЭС D. magna и других низших раков из отряда Anostraca. В частности, описанные Э. Е. Кулаковским [2, 3] у последних группы НСК по локализации, морфологии и особенностям функционирования сходны с таковыми у D. magna. Это свидетельствует о полной гомологии групп НСК Cladocera и Anostraca, что подтверждает их близкое эволюционное родство.
Однако в некоторых аспектах полученные нами результаты расходятся с данными указанного автора. Прежде всего, в отношении определения доли нейронов, вовлеченных в секреторный процесс. Признавая вслед за ним секреторную активность определенных специализированных нейронов церебрального ганглия, мы также считаем возможным выполнение этой функции большинством других Гомори-положительных клеток ЦНС в связи с наличием у них секреторного цикла и изменений их функционального состояния в соответствии с изменением уровня физиологического напряжения организма, определяемого состоянием репродуктивной системы.
Список литературы
1. Новожилова А.П., Бамбминдра В.П. Нейронная теория и новые концепции строения нервной системы // Морфология. 1996. Т. 110. №4. С. 7– 16.
2. Кулаковский Э.Е. Нейросекреторные клетки и их циклы в мозгу Artemia salina // Зоол. журн. 1976. Т. 60. №3. С. 354 – 362.
3. Кулаковский Э.Е. Нейросекреторная система Streptocephalus torvicornis (Crustacea, Branchiopoda) // Зоол. журн. 1980. Т. 59. №2. С. 181 – 185.
|